湖南人文科技學(xué)院
《基礎(chǔ)化學(xué)實(shí)驗(yàn)1》
-無(wú)機(jī)部分指導(dǎo)書(shū)
張海蓉 編著
2010年9月 湖南 婁底
目錄
1����、無(wú)機(jī)化學(xué)實(shí)驗(yàn)概論
2、玻管和滴管的制作�����、洗瓶的安裝
3����、天平的使用
4���、溶液的配制
5����、酸堿滴定
6�����、氯化鈉的提純
7��、置換法測(cè)定氣體常數(shù)R
8��、氣體密度法測(cè)定CO2的相對(duì)分子質(zhì)量
9�����、弱電解質(zhì)電離常數(shù)的測(cè)定
10���、I3-== I2+ I-體系平衡常數(shù)的測(cè)定
實(shí)驗(yàn)一無(wú)機(jī)化學(xué)實(shí)驗(yàn)概論
一�����、實(shí)驗(yàn)?zāi)康?/B>
1����、熟悉無(wú)機(jī)化學(xué)實(shí)驗(yàn)規(guī)則和要求
2、領(lǐng)取無(wú)機(jī)化學(xué)實(shí)驗(yàn)常用儀器�����,熟悉其名稱��,規(guī)則����,了解使用注意事項(xiàng)。
3��、學(xué)習(xí)并練習(xí)常用儀器的洗滌和干燥方法
二���、實(shí)驗(yàn)室規(guī)則和安全守則
(一) 實(shí)驗(yàn)室規(guī)則
1��、認(rèn)真聽(tīng)教師講解和演示�,明確實(shí)驗(yàn)要求和注意事項(xiàng)�。
3、認(rèn)真操作���,仔細(xì)觀察�,積極思考����,做好記錄����。
4��、愛(ài)護(hù)儀器�,節(jié)約藥品�,節(jié)約水電。
5��、公用儀器和藥品用后放回遠(yuǎn)處���,不得占為己有���。
6、按時(shí)上下課�����,不得隨意出入�,不大聲喧嘩。
7����、保持實(shí)驗(yàn)臺(tái)面清潔����,廢棄物要放入指定容器�����。
8���、實(shí)驗(yàn)后洗凈儀器��,擦凈臺(tái)面�,擺好用品�。
9、值日生打掃好衛(wèi)生��,關(guān)好門(mén)�、窗、水電再離開(kāi)實(shí)驗(yàn)室��。
(二) 安全規(guī)則
1��、不經(jīng)教師批準(zhǔn)���,不準(zhǔn)隨意混合藥品�����,也不準(zhǔn)隨意帶走藥品和儀器����。
2�、不用濕手觸摸電器。
3���、按規(guī)定實(shí)驗(yàn)方法�����、步驟和試劑用量進(jìn)行實(shí)驗(yàn)���。
4、使用濃酸���,濃堿時(shí)要防止灑出和腐蝕��。
5��、如遇割傷或燒傷要及時(shí)包扎處理��。
6���、酒精燈碰翻著火時(shí)�����,用濕布蓋滅����。
7���、有害廢液要倒入指定容器中����,統(tǒng)一處理�����。
8���、實(shí)驗(yàn)后洗凈雙手�����,離開(kāi)實(shí)驗(yàn)室����。
三、實(shí)驗(yàn)內(nèi)容與步驟
1���、對(duì)照清單認(rèn)領(lǐng)儀器����,清點(diǎn)裝置
2����、分類洗滌各種儀器
3����、練習(xí)玻璃儀器和瓷質(zhì)儀器的洗滌與干燥方法。
(一)玻璃儀器的洗滌
1����、儀器洗滌
為了使實(shí)驗(yàn)得到正確的結(jié)果,實(shí)驗(yàn)所用的玻璃儀器必須是潔凈的�,有些實(shí)驗(yàn)還要求是干燥的��,所以需對(duì)玻璃儀器進(jìn)行洗滌和干燥�。要根據(jù)實(shí)驗(yàn)要求���、污物性質(zhì)和玷污的程度選用適宜的洗滌方法���。玻璃儀器的一般洗滌方法有沖洗、刷洗及藥劑洗滌等��。對(duì)一般沾附的灰塵及可溶性污物可用水沖洗去�����。洗滌時(shí)先往容器內(nèi)注入約容積1/3的水���,稍用力振蕩后把水倒掉��,如此反復(fù)沖洗數(shù)次�。
當(dāng)容器內(nèi)壁附有不易沖洗掉的污物時(shí)�,可用毛刷刷洗,通過(guò)毛刷對(duì)器壁的摩擦去掉污物�����。刷洗時(shí)需要選用合適的毛刷。毛刷可按所洗滌的儀器的類型��,規(guī)格(口徑)大小來(lái)選擇�。洗滌試管和燒瓶時(shí),端頭無(wú)直立豎毛的禿頭毛刷不可使用(為什么�����?)�����。刷洗后�����,再用水連續(xù)振蕩數(shù)次���。沖洗或刷洗后,必要時(shí)還應(yīng)用蒸餾水淋洗三次�����。對(duì)于以上兩法都洗不去的污物則需要洗滌劑或藥劑來(lái)洗滌。對(duì)油污或一些有機(jī)污物等��,可用毛刷蘸取肥皂液或合成洗滌劑或去污粉來(lái)刷洗��。對(duì)更難洗去的污物或儀器口徑較小���、管細(xì)長(zhǎng)不便刷洗時(shí)的儀器可用鉻酸洗液或王水洗滌���,也可針對(duì)污物的化學(xué)性質(zhì)選用其他適當(dāng)?shù)乃巹┫礈欤ɡ鐗A,堿性氧化物��,碳酸鹽等可用6mol.L-1HCl溶解)�。用鉻酸洗液或王水洗滌時(shí),先往儀器內(nèi)注入少量洗液���,使儀器傾斜并慢慢轉(zhuǎn)動(dòng)����,讓儀器內(nèi)壁全部被洗液濕潤(rùn)��。再轉(zhuǎn)入儀器�����,使洗液在內(nèi)壁流動(dòng),經(jīng)流動(dòng)幾圈后���,把洗液倒回原瓶(不可倒入水池或廢液桶�,鉻酸洗液變暗綠色失效后可另外回收再生使用)���。對(duì)玷污嚴(yán)重的儀器可用洗液浸泡一段時(shí)間�,或者用熱洗液洗滌�����。用洗液洗滌時(shí)�����,決不允許將毛刷放入洗瓶中?����。槭裁?��?)傾出洗液后,再用水沖洗或刷洗�,必要時(shí)還應(yīng)用蒸餾水淋洗。
2、洗凈標(biāo)準(zhǔn)
儀器是否洗凈可通過(guò)器壁是否掛水珠來(lái)檢查����。將洗凈后的儀器倒置,如果器壁透明���,不掛水珠����,則說(shuō)明已洗凈����;如器壁有不透明處或附著水珠或有油斑,則未洗凈應(yīng)予重洗���。
(二)玻璃儀器的干燥
晾干:是讓殘留在儀器內(nèi)壁的水分自然揮發(fā)而使儀器干燥�。
烘箱烘干:儀器口朝下��,在烘箱的最下層放一陶瓷盤(pán)����,接住從儀器上滴下來(lái)的水,以免水損壞電熱絲�����。
烤干:燒杯,蒸發(fā)皿等可放在石棉網(wǎng)上�����,用小火烤干��,試管可用試管夾夾住����,在火焰上來(lái)回移動(dòng),直至烤干�����,但管口須低于管底��。
氣流烘干:試管�����、量筒等適合在氣流烘干器上烘干��。
電熱風(fēng)吹干
注:帶有刻度的計(jì)量?jī)x器不能用加熱的方法進(jìn)行干燥�����。
四����、實(shí)驗(yàn)注意事項(xiàng):
(1)儀器壁上只留下一層既薄又均勻的水膜,不掛水珠��,這表示儀器已洗凈����。
(2)已洗凈的儀器不能用布或紙抹。
(3)不要未倒廢液就注水
(4)不要幾只試管一起刷洗
(5)用水原則是少量多次
五����、思考題
1、烤干試管時(shí)為什么管口略向下傾斜�����?
2�、什么樣的儀器不能用加熱的方法進(jìn)行干燥,為什么�����?
3、畫(huà)出離心試管�����、多用滴管��、井穴板���、量筒���、容量瓶的簡(jiǎn)圖,討論其規(guī)格�����、主要用途和注意事項(xiàng)����。
實(shí)驗(yàn)二玻管和滴管的制作、洗瓶的安裝
一�、實(shí)驗(yàn)?zāi)康?/B>
1、弄清酒精噴燈的構(gòu)造和原理��,掌握正確的使用方法。
2��、了解正?����;鹧娌糠值臏囟?����。
3�����、學(xué)會(huì)截?cái)?�、彎曲�����、拉制����、熔燒玻璃管(棒)的基本操作?/p>
4�����、練習(xí)塞子鉆孔
二、實(shí)驗(yàn)內(nèi)容與步驟
1�����、實(shí)驗(yàn)前的準(zhǔn)備
1�、穿好實(shí)驗(yàn)服,準(zhǔn)備做實(shí)驗(yàn)�����。
2�����、保持臺(tái)面整潔�����,實(shí)驗(yàn)前先擦凈臺(tái)面����。
3、檢查工具���,儀器:酒精噴燈�����,石棉網(wǎng)���,銼刀�,玻璃管�����,玻璃棒�、燒杯�,膠塞,塑料瓶漏斗,鉆孔器�,工業(yè)酒精。
2����、酒精噴燈的使用
1)、類型和構(gòu)造
分為座式和掛式酒精噴燈(示意圖見(jiàn)書(shū))���。座式酒精噴燈的構(gòu)造:a燈管��、b空氣調(diào)節(jié)器�����、c預(yù)熱盤(pán)���、d銅帽��、e酒精壺
2)�、使用
①添加酒精�;燒杯取適量酒精,擰下銅帽���,用漏斗向酒精壺內(nèi)添加酒精�,酒精量不超過(guò)其體積的2/3�。
②預(yù)熱盤(pán)中加適量酒精(盛酒精的燒杯須遠(yuǎn)離火源)并點(diǎn)燃,充分預(yù)熱�,保證酒精全部氣化,并適時(shí)調(diào)節(jié)空氣調(diào)節(jié)器�。
③當(dāng)燈管中冒出的火焰呈淺藍(lán)色,并發(fā)出“哧哧”的響聲時(shí)���,擰緊空氣調(diào)節(jié)器��,此時(shí)可以進(jìn)行玻管加工了���。正常的氧化火焰分為三層:a氧化焰(溫度約800~900℃)��;b還原焰�����;c焰心�����;d最高溫度點(diǎn)。
④若一次預(yù)熱后不能點(diǎn)燃噴燈時(shí)����,可在火焰熄火后重新往預(yù)熱盤(pán)添加酒精(用石棉網(wǎng)或濕抹布蓋在燈管上端即可熄滅酒精噴燈),重復(fù)上述操作點(diǎn)燃�。但連續(xù)兩次預(yù)熱后仍不能點(diǎn)燃時(shí),則需用捅針疏通酒精蒸氣出口后���,方可再預(yù)熱���。
⑤座式噴燈連續(xù)使用不應(yīng)過(guò)長(zhǎng)�,如果超過(guò)半個(gè)小時(shí)����,應(yīng)先暫時(shí)熄滅噴燈。冷卻��,添加酒精后繼續(xù)使用��,在使用過(guò)程中,要特別注意安全�,手盡量不要碰到酒精噴燈金屬部位。
3�、玻璃管(棒)的燒制加工
1)、截?cái)嗖AЧ芎筒AО?/p>
(1)先用一些玻璃管(棒)反復(fù)練習(xí)截?cái)嗖AЧ?棒)的基本操作���。
(2)制作長(zhǎng)14cm�,16cm��,18cm玻璃棒各一根���,斷口熔燒至圓滑(不要燒過(guò)頭)�。
2)����、拉細(xì)玻璃管和玻璃棒
(1)練習(xí)拉細(xì)玻璃管和玻璃棒的基本操作��。
(2)制作小攪棒和滴管各二支�,規(guī)格如圖所示���。

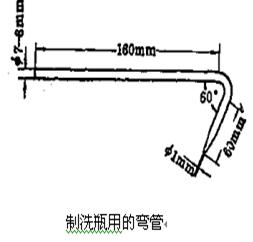
3)���、彎曲玻璃管
(1)練習(xí)玻璃管的彎曲:彎成120°、90°��、60°等角度���。
(2)制作規(guī)格如圖的玻璃管一支��,以作裝配洗瓶用����。
4����、塞子鉆孔
1)�、按塑料瓶口直徑的大小選取一合適的橡膠塞,塞于應(yīng)能塞入瓶口l/2—2/3為宜.
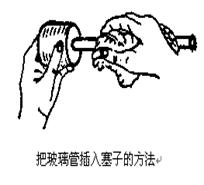 2)���、按玻璃管直徑選用一個(gè)鉆孔管����,在所選膠塞中間鉆出一孔。鉆孔時(shí)���,切記左手按緊膠塞����,以防旋壓打孔器時(shí)�,塞子移動(dòng)打滑、損傷手指���。
2)���、按玻璃管直徑選用一個(gè)鉆孔管����,在所選膠塞中間鉆出一孔。鉆孔時(shí)���,切記左手按緊膠塞����,以防旋壓打孔器時(shí)�,塞子移動(dòng)打滑、損傷手指���。
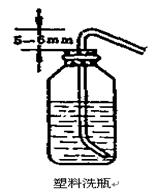
5��、裝配洗瓶
1)�����、把制作好的彎管按上圖所示的方法�����,邊轉(zhuǎn)邊插入膠塞中去��。操作時(shí)玻璃管可先蘸些水或甘油等潤(rùn)滑劑以保持潤(rùn)滑��,不能硬塞�。孔徑過(guò)小時(shí)可用圓銼把孔銼大些��,以防玻璃管折斷而傷手�����。
2)��、把已插入橡膠塞中的玻璃彎管的下端按右圖所示的要求�,在離下口3cm處(管若已沾水則需小心烘干)彎一150°角,此彎管方向與上部彎管一致并處于同一水平面上��。
三����、實(shí)驗(yàn)注意事項(xiàng)
燒熔滴管小口一端要特別小心,不能久置于火焰中��,以免管口收縮��,甚至封死�。粗口一端則應(yīng)燒軟,然后在石棉網(wǎng)上垂直如壓(不能用力過(guò)大)�,使管口變厚略向外翻,便于套上橡皮吸頭�。制作的滴管規(guī)格要求是從滴管滴出20一25滴水體積約等于1cm3。
四����、思考題
1、在切割燒制玻璃管(棒)以及往塞孔內(nèi)穿進(jìn)玻璃管等操作中��,應(yīng)注意哪些安全問(wèn)題?剛灼燒過(guò)的灼熱玻璃和冷的玻璃往往外表難以分辨��,如何防止?fàn)C傷��?
2��、煤氣燈正?����;鹧嬗赡娜糠纸M成����?應(yīng)用哪一部分火焰加熱?如何增大玻璃管受熱面積?
實(shí)驗(yàn)三 天平的使用和稱量
一、實(shí)驗(yàn)?zāi)康?/B>
1���、了解托盤(pán)天平和電光分析天平的構(gòu)造
2�、學(xué)習(xí)天平的正確使用方法
3�、初步掌握用差減稱量法,直接稱量法稱取一定質(zhì)量范圍的樣品���。
4����、了解在稱量中如何運(yùn)用有效數(shù)字�。
5、學(xué)會(huì)正確使用稱量瓶
二�、儀器和藥品
分析天平,干燥的稱量紙��,金屬鎳片�����,干燥的碳酸鈉
三�、實(shí)驗(yàn)原理
分析天平是根據(jù)杠桿原理設(shè)計(jì)而成的。
設(shè)杠桿ABC(見(jiàn)圖1)�����,B為支點(diǎn)���,A為重點(diǎn)�,C為力點(diǎn)���。在A及C上分別載重Q及P����,Q為被稱物的重量�����,P為砝碼的重量��,P為砝碼的總重量���。當(dāng)達(dá)到平衡時(shí)�,既ABC杠桿呈水平根據(jù)杠桿態(tài)��,則根據(jù)杠桿原理Q×AB=P×BC�,若B為ABC的中點(diǎn),則AB=BC,所以Q=P���,這就是等臂天平的原理����,像國(guó)產(chǎn)TG528B型�、TG629型阻尼天平、TB型半自動(dòng)電光天平��、TG328A型全自動(dòng)天平均屬此等臂天平�。
若B點(diǎn)不是中點(diǎn),Q為固定的重量錘�����,P為總法碼重量����,但Q×AB=P×BC,當(dāng)稱物體重量時(shí)���,減去P的砝碼����,仍使Q×AB=(物重+P-砝碼)×BC,這就是不等臂天平的原理��,如國(guó)產(chǎn)TG729B型單盤(pán)減碼式全自動(dòng)電光天平�����。
圖1 天平原理圖
TG328型半自動(dòng)電光天平的結(jié)構(gòu)圖見(jiàn)圖2��,它比阻尼天平增加了兩個(gè)裝置�����,一個(gè)是光學(xué)讀數(shù)裝置���,另一個(gè)是機(jī)械加碼裝置。光電裝置中的投影屏中可直接讀出10mg以下的重量���;機(jī)械加碼裝置中�����,砝碼由指數(shù)盤(pán)操縱�����,自動(dòng)加?�?�;大小砝碼全部由指數(shù)盤(pán)操縱稱為全自動(dòng)電光天平(如TG328A)����,1 g以下的砝碼由指數(shù)盤(pán)操縱稱為半自動(dòng)電光天平(TG328B)。
電光天平的最大稱量為20-200g���,稱至0.1mg 的稱為萬(wàn)分之一天平����,稱至0.01mg的為十萬(wàn)分之一天平�����,稱0.001mg的為百萬(wàn)分之一天平�。
天平的靈敏度是指在天平的一個(gè)托盤(pán)上增加1.0mg時(shí),所引起的指針偏斜的程度�。指針偏斜程度愈大,則該天平的靈敏度愈高����。
設(shè)等臂天平(如圖3)的臂長(zhǎng)為l���,d為重心G或G到支點(diǎn)O的距離,W為梁重��,p為稱盤(pán)重�,m為增加的小重量。當(dāng)天平兩邊都是空盤(pán)時(shí)�����,指針位于OD處�����,而當(dāng)右邊稱盤(pán)增加重量m時(shí)��,指針偏斜至OD處�,橫梁由OA偏斜至OA����,
其偏斜角為α,則根據(jù)原理�����,支點(diǎn)右邊的力矩等于支點(diǎn)左邊的力矩之和,即:
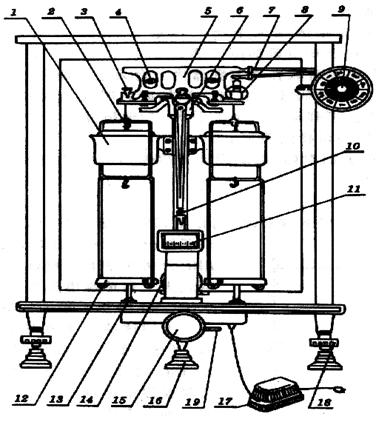
1—阻尼盒 2—吊耳 3—支點(diǎn)刀 4—平衡螺絲 5—橫梁 6—支點(diǎn)刀口 7—環(huán)碼鉤
8—支柱 9—機(jī)械加碼器 10—指針 11—投影屏 12—天平盤(pán) 13—盤(pán)托 14—光源
15—旋鈕(升降樞)16—墊腳 17—變壓器 18—螺旋腳 19—微動(dòng)調(diào)節(jié)桿
圖2半自動(dòng)電光天平

圖3 天平靈敏度原理圖
(p + m) × OA = p × OB + W × CG′ m × OB = W × CG′
OB = A'O × cosα=l× cosα
CG' = ogsinα= d × sinα
m ×l× cosα= W × d × sinα
 ��,
��,
由于α一般很小��,所以可認(rèn)為:
tanα = α�����,因α =
當(dāng)m = 1mg α =
此式即是靈敏度的簡(jiǎn)易公式�。由公式可知,天平的靈敏度與以下因素有關(guān):
天平的臂長(zhǎng)愈長(zhǎng)�,靈敏度愈高;天平的梁重愈重����,靈敏度愈低;支點(diǎn)與重心間的距離愈短�����,靈敏度愈高����。
但是天平的靈敏度并非僅與這三個(gè)因素有關(guān),還與天平梁載重時(shí)的變形����,支點(diǎn)和載重點(diǎn)的瑪瑙刀的接觸點(diǎn)(即瑪瑙刀的刀口尖銳性及平整性)有關(guān)��。所以�����,天平梁制成三角狀�,中間挖空����,三角狀頂上設(shè)一垂直的靈敏度調(diào)節(jié)螺絲,水平方向設(shè)置兩個(gè)零點(diǎn)調(diào)節(jié)螺絲����,支點(diǎn)瑪瑙刀口略低于載重瑪瑙刀口的翹梁式����,且天平梁的材質(zhì)采用鋁合金或鈦合金等輕金屬制成。
三角狀翹梁是為了減少變形影響����,挖空及輕金屬材質(zhì)是為了減輕梁重的措施,靈敏度調(diào)節(jié)螺絲是為了利用螺母本身質(zhì)量的高低位置來(lái)調(diào)節(jié)d的長(zhǎng)度�����,水平零點(diǎn)調(diào)節(jié)螺絲是利用螺母質(zhì)量調(diào)節(jié)螺母離支點(diǎn)的距離來(lái)調(diào)整力矩的大小改變零點(diǎn)位置。
天平的靈敏度一般以標(biāo)牌的格數(shù)來(lái)衡量��,即靈敏度=格/ mg���,但實(shí)際上經(jīng)常用“感量”來(lái)表示:感量=1/靈敏度= mg/格��。
電光天平的感量一般調(diào)成1mg/格�����、0.1 mg/格��、0.01 mg/格���,將標(biāo)牌制成透明膜,裝在指針上���,然后�,通過(guò)光學(xué)放大10倍使天平的表觀“感量”成1mg/格����、0.1 mg/格���、0.01 mg/格、0.001 mg/格���。因此�����,又稱萬(wàn)分之一天平���,十萬(wàn)分之一天平、百萬(wàn)分之一天平���。由于實(shí)際感量較低����,所以它能很快達(dá)到平蘅�,既達(dá)到快速稱重��,又能提高讀數(shù)的精密度���,且在10mg(對(duì)十萬(wàn)分之一天平是1mg�,對(duì)百萬(wàn)分之一天平是0.1mg)以內(nèi)的稱重?zé)o須加砝碼直接由屏幕上讀數(shù)。
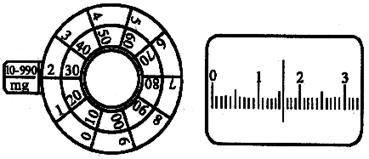
圖4 天平讀數(shù)
天平的讀數(shù):克以上的讀取可由砝碼而得���,克以下的由加碼器上的數(shù)加上投影屏上的數(shù)字����,而投影屏上的最后位數(shù)采取“四舍六入五入雙”的辦法����。例如現(xiàn)在天平右盤(pán)放有20克砝碼,而旋轉(zhuǎn)圈砝碼指示盤(pán)旋鈕停止后�,投影屏上的零點(diǎn)指示線在如圖d所指的位置,這時(shí)物質(zhì)的質(zhì)量為20 + 0.230 + 0.0016 = 20.2316(克)
電光天平的稱量方法有三種:
直接稱量法:
將所稱的物質(zhì)如坩鍋�����、小燒杯����、小表皿……等直接置于電關(guān)天平的左邊或(右邊)稱量盤(pán)上,加法碼或轉(zhuǎn)動(dòng)指數(shù)盤(pán)到投影屏平衡�,則所加砝碼既是所稱物質(zhì)的質(zhì)量。
指定重量稱量法:
當(dāng)稱取不吸水����、在空氣中性質(zhì)穩(wěn)定的試樣��,如金屬試樣�����、礦石試樣等�����,可采用此法��。即先稱容器重量(如燒杯表面皿��、鋁鏟�����、硫酸紙等)�����,然后將砝碼或指數(shù)盤(pán)加到指定重量�����,用牛角匙輕輕震動(dòng)使試樣慢慢到入容器��,使平衡點(diǎn)與稱容器時(shí)一致�����。
減量法:
當(dāng)樣品易吸水���、易氧化或易與二氧化碳反應(yīng)時(shí),則采用此法���。先將樣品置于稱量瓶中����,稱出試樣加稱量瓶的總質(zhì)量W�����,然后將樣品傾倒一部分�����,再稱剩余式樣加稱量瓶的質(zhì)量為W����,則第一份式樣質(zhì)量為(W1-W2)克����,依次類推��,稱出第二份���,第三份式樣……�。
若是易吸水����、易氧化或易與二氧化碳反映的液體樣品�,如濃硫酸,氫氧化鈉……等�,可將式樣裝入小滴瓶中代替稱量瓶并象上述一樣步驟進(jìn)行�。稱量取藥品時(shí)按圖所示步驟進(jìn)行:從干燥器中取出轉(zhuǎn)有藥品的稱量瓶�,用小紙片夾住稱量瓶,在接受器的上方�����,打開(kāi)瓶蓋�,傾斜瓶身�����,用瓶蓋輕敲瓶口上部使試樣慢慢落入容器中見(jiàn)圖5。當(dāng)傾出的樣品接近所需量時(shí)�,一邊繼續(xù)輕敲瓶口,一邊逐漸將瓶身豎直����,使沾在瓶口的式樣進(jìn)入接受器,然后蓋上瓶蓋����,放回托盤(pán)上,準(zhǔn)確稱取其質(zhì)量�,兩次質(zhì)量之差即為所稱樣品的質(zhì)量
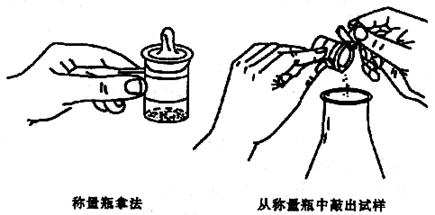
圖5 稱量
光天平是一種精密而貴重的儀器,為了保持儀器的精密度使稱量能獲得準(zhǔn)確的結(jié)果���,使用時(shí)應(yīng)遵守下列規(guī)則:
1���、光天平應(yīng)放在室溫均勻的牢固臺(tái)面上,避免震動(dòng)��、潮濕�����、陽(yáng)光照射及腐蝕性氣體。
2��、前必須檢查天平是否處于水平狀態(tài)��,然后再稱�����。
3�����、在天平稱量盤(pán)上放置或取下被稱物�,加減砝碼及輕輕裝動(dòng)指數(shù)盤(pán)時(shí),必須下把天平梁托住��,輕放輕取緩慢轉(zhuǎn)動(dòng)�����。下降或升起天平梁時(shí)�����,應(yīng)小心緩慢,否則均容易使瑪瑙刀口損壞���。
4��、未知樣品質(zhì)量時(shí)�����,加減砝碼或轉(zhuǎn)動(dòng)指數(shù)盤(pán)后,用半開(kāi)狀態(tài)觀察是否接近平衡點(diǎn)�,可以從投影屏上移動(dòng)方向和速度衡量;若向-1方向移動(dòng)��,表示砝碼重了����,需砝碼,若向+1方向移動(dòng)����,表示砝碼輕了,需加砝碼�����;若移動(dòng)速度愈快,表示離平衡愈遠(yuǎn)����,加減砝碼量要大,若移動(dòng)速度愈慢���,加減砝碼愈小���。切勿在全開(kāi)狀態(tài)觀察,易使刀口損壞����,且容易發(fā)生吊耳脫落。
5�����、物體的溫度應(yīng)與室溫一致����,否則會(huì)使稱量結(jié)果不準(zhǔn)確。這是因?yàn)榉Q量盤(pán)附近空氣受熱膨脹而發(fā)生對(duì)流及天平臂長(zhǎng)的熱膨脹引起誤差而造成的����。
6�、腐蝕服物質(zhì)��、易揮發(fā)�����、易吸水���、易與二氧化碳作用或易氧化的物質(zhì)稱重時(shí)�,必須放在密閉容器內(nèi)進(jìn)行稱重�。
7����、同一分析工作中稱量應(yīng)使用同一臺(tái)天平與砝碼,可減少稱量誤差�。
8、稱量時(shí)����,要關(guān)緊天平門(mén),防止空氣流動(dòng)所造成的誤差�����。
9、天平箱要保持干燥����,并放有變色硅膠,若變成粉紅色應(yīng)干燥處理后再放入�。
10、稱量完畢�,應(yīng)關(guān)上升降架,取出被稱量物體和砝碼���,指數(shù)盤(pán)復(fù)零�����,并用毛刷打掃干凈�����,關(guān)上天平門(mén)���,罩上布罩,關(guān)上電源后�����,再離開(kāi)天平室。
四�����、實(shí)驗(yàn)內(nèi)容與步驟(練習(xí)稱量鎳片���,碳酸鈉���,一張紙)
1、零點(diǎn)的調(diào)節(jié)
零點(diǎn):天平的零點(diǎn)��,指天平“空”載時(shí)的平衡點(diǎn)����。每次稱量之前都要先測(cè)定天平零點(diǎn)�����。測(cè)定時(shí)接通電源����,輕輕開(kāi)啟升降樞�����,應(yīng)全部啟開(kāi)旋鈕����,此時(shí)可以看到縮微標(biāo)尺的投影在光屏上移動(dòng)���。當(dāng)標(biāo)尺投影穩(wěn)定后��,若光屏上的刻線不與標(biāo)尺0.00重合�����,可撥動(dòng)扳手����,移動(dòng)光屏位置����,使刻線與標(biāo)尺0.00重合,零點(diǎn)即調(diào)好����。若光屏移到盡頭刻線還不能與標(biāo)尺0.00重合���,則在教師指導(dǎo)下通過(guò)旋轉(zhuǎn)平衡螺絲來(lái)調(diào)整。
2����、稱量物體
(1)在使用分析天平稱量物體之前應(yīng)將物體先在臺(tái)稱上粗稱,然后把要稱量物體放入天平左盤(pán)中央�,把比粗稱數(shù)略重的砝碼放在右盤(pán)中央,慢慢打開(kāi)升降樞���,根據(jù)指針的偏轉(zhuǎn)方向或光屏上標(biāo)尺移動(dòng)方向來(lái)變換砝碼�����。如果標(biāo)尺向反方向移動(dòng)���,即光屏上標(biāo)尺的零點(diǎn)偏向標(biāo)尺的右方,則表示砝碼重���,應(yīng)立即關(guān)好升降樞,減少砝碼后再稱重����。反復(fù)加減砝碼至稱量物比砝碼重不超過(guò)1g時(shí)��,再轉(zhuǎn)動(dòng)指數(shù)盤(pán)加減圈碼�����,直至光屏上的刻線與標(biāo)尺投影上某一讀數(shù)重合為止����。
(2)稱量方法包括直接法和減量法兩種�����。
(3)讀數(shù):當(dāng)光屏上的標(biāo)尺投影穩(wěn)定后�,即可從標(biāo)尺上讀出10mg以下的質(zhì)量。標(biāo)尺上讀數(shù)一大格為0.1mg����,稱量物體質(zhì)量(g)=砝碼質(zhì)量+ 圈碼質(zhì)量+
圈碼質(zhì)量+ 光標(biāo)尺讀數(shù)。
光標(biāo)尺讀數(shù)。
3���、數(shù)據(jù)記錄與處理
4����、稱后檢查
稱量完畢��,記下物體質(zhì)量,將物體取出�,砝碼依次放回盒內(nèi)原來(lái)位置。關(guān)好邊門(mén)���。圈碼指數(shù)盤(pán)恢復(fù)到0.00位置���,拔下電插銷,罩好天平罩�。
五、實(shí)驗(yàn)注意事項(xiàng)
(1)天平室應(yīng)避免陽(yáng)光照射��,保持干燥�����,天平應(yīng)放在穩(wěn)固的臺(tái)上�,避免震動(dòng)。
(2)天平箱內(nèi)應(yīng)保持清潔��,要定期放置和更換吸濕變色干燥劑�,以保持干燥。
(3)稱量物體不得超過(guò)天平的最大載重量(一般為200g).
(4)不得在天平上稱量熱的或散發(fā)腐蝕性氣體的物質(zhì)�����。
(5)開(kāi)關(guān)天平要輕緩�。加取物體和砝碼時(shí),應(yīng)先關(guān)天平的升降樞��。
(6)加減砝碼時(shí)��,必須用鑷子夾取�����,取下的砝碼應(yīng)放在砝碼盒內(nèi)的固定位置上�����,不能到處亂放�,更不能用其他天平的砝碼。
(7)稱量的物品���,必須放在適當(dāng)?shù)娜萜髦?���,不得直接放在天平盤(pán)上�����。
(8)稱量完畢應(yīng)將各部件恢復(fù)原位,關(guān)好天平門(mén)��,罩上天平罩���,切斷電源����。并檢查盒內(nèi)砝碼是否完整無(wú)缺和清潔���,最后在天平使用登記本上寫(xiě)清使用情況�。
(9)禁止在天平開(kāi)啟狀態(tài)開(kāi)側(cè)門(mén)�、添加(或減小)砝碼或物品��。
(10)不要長(zhǎng)讓天平處于工作狀態(tài)
六�����、思考題
1���、分析天平的靈敏度主要取決于天平的什么零件�?稱量時(shí)應(yīng)如何維護(hù)天平的靈敏性?
2�、稱量的樣品不能只放在托盤(pán)或稱盤(pán)時(shí),應(yīng)如何選擇盛接物�����?
3�����、什么情況下用直接稱量法�?什么情況下需用減量法稱量�����?
4�、用減量法稱取試樣時(shí),若稱量瓶?jī)?nèi)的試樣吸濕�����,對(duì)稱量結(jié)果造成什么誤差�?若試樣傾倒入燒杯內(nèi)以后再吸濕,對(duì)稱量結(jié)果是否有影響��?
5、分析天平稱量時(shí)��,被稱物品的溫度高于室穩(wěn)�,對(duì)稱量將有什么影響?
實(shí)驗(yàn)四 溶液的配制
一�、實(shí)驗(yàn)?zāi)康?/B>
1、了解和學(xué)習(xí)實(shí)驗(yàn)室常用溶液的配制方法�����。
2�、學(xué)習(xí)容量瓶和移液管的使用方法。
二��、儀器和藥品
托盤(pán)天平�����,電子分析天平�����,容量瓶(200 cm3�、100 cm3),滴瓶����,吸量管(10cm3)�����,洗瓶���,燒杯(100 cm3),稱量瓶�����,玻棒�����。
托盤(pán)天平的使用
托盤(pán)天平(如圖1)又稱臺(tái)天平��、臺(tái)秤��,用于粗略的稱量.能稱準(zhǔn)至0.1g��。臺(tái)天平的橫梁架在臺(tái)天平座上�����。橫梁左右有兩個(gè)盤(pán)子���。橫梁中部的上面有指針�,根據(jù)指針A在刻度盤(pán)B擺動(dòng)的情況.可以看出臺(tái)天平的平衡狀態(tài)�。使用臺(tái)天平稱量時(shí),可按下列步驟進(jìn)行:
1.零點(diǎn)調(diào)整:使用臺(tái)天平前常把游碼D放在刻度尺的零處����。托盤(pán)中未放物體時(shí),如指
針不在刻度零點(diǎn)附近��,可用零點(diǎn)調(diào)節(jié)螺絲C調(diào)節(jié)����。
2.稱量:稱量物不能直接放在天平盤(pán)上稱量(避免天平盤(pán)受腐蝕),應(yīng)放在稱量紙或表面皿上����,潮濕或具腐蝕性的藥品則應(yīng)放在玻璃容器內(nèi)。天平不能稱熱的物質(zhì)�。
稱量時(shí),稱量物放在左盤(pán)���,法碼放在右盤(pán)���。添加法碼時(shí)應(yīng)從大到小���,在添加刻度標(biāo)尺E以內(nèi)質(zhì)量時(shí)(例如10 g或5g),可移動(dòng)標(biāo)尺上的游碼�。直至指針指示的位置與零點(diǎn)相符(偏差不超過(guò)1格)。記下法碼質(zhì)量���,此質(zhì)量即稱量物的質(zhì)量�����。
3.稱量完畢,應(yīng)把法碼放回盒內(nèi)�����,把游標(biāo)尺的游碼移到刻度“0”處�,將臺(tái)天平打掃干凈。

電子天平的使用
應(yīng)用現(xiàn)代電子控制技術(shù)進(jìn)行稱量的天平稱為電子分析天平�����。它是一種十分精確的稱量?jī)x器����,可精確稱量至0.0001g�����,它是利用電磁力平衡原理對(duì)物體進(jìn)行稱量的�,是一可靠性強(qiáng)��,操作簡(jiǎn)便的稱量?jī)x器���。BS系列電子天平的稱量范圍為0~210g�����,其外觀結(jié)構(gòu)如圖2所示���。電子分析天平的操作方法如下:
(1)調(diào)水平。調(diào)整地腳螺栓高度��,使水平儀內(nèi)空氣泡位于圓環(huán)中央�����。
(2)開(kāi)機(jī)��。接通電源,按開(kāi)關(guān)鍵 直至全屏自檢��。
直至全屏自檢��。
(3)預(yù)熱�。天平在初次接通電源或長(zhǎng)時(shí)間斷電后,至少需要預(yù)熱30分鐘���。為取得理想的測(cè)量結(jié)果��,天平應(yīng)保持待機(jī)狀態(tài)���。
(4)校正。首次使用天平必須校正�����,按校正鍵���,天平將顯示所需校正砝碼重量,放上砝碼直至出現(xiàn)“g”���,校正結(jié)束�����,可進(jìn)行正常稱量����。
(5)稱量。如需去除器皿皮重�����,則先將器皿放在稱盤(pán)上���,待示值穩(wěn)定后�����,按除皮鍵�,除皮清零�。然后將需稱樣品放于器皿上,此時(shí)顯示的數(shù)值為樣品凈重���。
(6)關(guān)機(jī)�����。
為使天平保持保溫狀態(tài)��,延長(zhǎng)天平使用壽命���。應(yīng)使天平保持通電狀態(tài)�����,不使用時(shí)��,將開(kāi)關(guān)鍵關(guān)至待機(jī)狀態(tài)��。
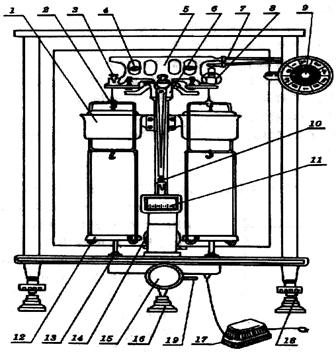
圖2電子分析天平外形圖
1—稱盤(pán)�;2—屏蔽環(huán)�;3—地腳螺栓;4—水平儀���;5—功能鍵����;6—清除鍵��;7—除皮���;8—打印鍵�����;9—調(diào)校鍵����;10—開(kāi)關(guān)鍵��;11—顯示器�����;12—稱盤(pán)支架
三�����、實(shí)驗(yàn)原理
無(wú)機(jī)化學(xué)實(shí)驗(yàn)通常配制的溶液有一般溶液和標(biāo)準(zhǔn)溶液
一)�、一般溶液的配制
配制一般溶液常用以下三種方法:
(1)直接水溶法:
對(duì)易溶于水而不發(fā)生水解的固體試劑,例如NaOH��、H2C2O4�、KNO3、NaCl等�����,配制其溶液時(shí),可用托盤(pán)天平稱取一定量的固體于燒杯中�����,加入少量蒸餾水�,攪拌溶解后稀釋至所需體積,再轉(zhuǎn)移入試劑瓶中���。
(2)介質(zhì)水溶法
對(duì)易水解的固體試劑����,如FeCl3�、SbCl3、BiCl3等��。配制其溶液時(shí)�����,稱取一定量的固體�����,加入適量一定濃度的酸(或堿)使之溶解,再以蒸餾水稀釋���,搖勻轉(zhuǎn)入試劑瓶。
(3)稀釋法
對(duì)于液態(tài)試劑�,如HCl、H2SO4���、HNO3��、HAC等��。配制其稀溶液時(shí)�,先用量筒量取所需量的濃溶液����,然后用適量的蒸餾水稀釋。
二)�����、標(biāo)準(zhǔn)溶液的配制
已知準(zhǔn)確濃度的溶液稱為標(biāo)準(zhǔn)溶液����。配制標(biāo)準(zhǔn)溶液的方法有兩種:
(1)直接法
用分析天平準(zhǔn)確稱取一定量的基準(zhǔn)試劑于燒杯中����,加入適量的離子交換水溶解后���,轉(zhuǎn)入容量瓶中��,再用離子交換水稀釋至刻度�����,搖勻��。其準(zhǔn)確濃度可由稱量數(shù)據(jù)及稀釋體積求得����。
(2)標(biāo)定法
不符合基準(zhǔn)試劑條件的物質(zhì)���,不能用直接法配制標(biāo)準(zhǔn)溶液��,但可先配成近似于所需濃度的溶液�,然后用基準(zhǔn)試劑或已知準(zhǔn)確濃度的標(biāo)準(zhǔn)溶液標(biāo)定它的濃度����。
當(dāng)需要通過(guò)稀釋法配制標(biāo)準(zhǔn)溶液的稀溶液時(shí)��,可用移液管準(zhǔn)確吸取其濃溶液至適當(dāng)?shù)娜萘科恐信渲啤?/p>
四���、實(shí)驗(yàn)內(nèi)容與步驟
一)、酸��、堿溶液的配制
1.配制100ml 6 mol·dm-3NaOH溶液��,儲(chǔ)于滴瓶中�����。
2.用濃硫酸�����、濃鹽酸��、濃硝酸分別配制3 mol·dm-3硫酸���、6 mol·dm-3鹽酸、6 mol·dm-3硝酸溶液各100 cm3�����、分別儲(chǔ)于滴瓶中。
二)����、鹽溶液的配制
配制0.1 mol·dm-3的NaCl、FeSO4溶液各100cm3�,并儲(chǔ)于滴瓶中。
三)�、標(biāo)準(zhǔn)溶液的配制
1.KHC8H4O4溶液的配制
準(zhǔn)確稱取4.0840~4.0850g KHC8H4O4晶體于燒杯中,加入少量水使其完全溶解后��,轉(zhuǎn)移至200cm3容量瓶中����,再用少量水淋洗燒杯及玻棒數(shù)次,并將每次淋洗的水全部轉(zhuǎn)入容量瓶中����,最后以水稀釋至刻度,搖勻��。計(jì)算其準(zhǔn)確濃度�。
2.Na2B4O7溶液的配制
準(zhǔn)確稱取3.8120~3.8130g Na2B4O7·10H2O晶體,按上述方法配成200cm3溶液���,計(jì)算其準(zhǔn)確濃度���。
3.NaCl標(biāo)準(zhǔn)溶液的稀釋
用已知濃度為1.000 mol·dm-3的NaCl溶液配制0.1000mol·dm-3的NaCl溶液100cm3����。
五��、實(shí)驗(yàn)注意事項(xiàng)
1.配制H2SO4溶液時(shí)需特別注意���,應(yīng)在不斷攪拌下將濃H2SO4緩慢地倒入盛水的容器中���,而不能將操作順序倒過(guò)來(lái)�����。
2.一些容易見(jiàn)光分解或容易發(fā)生氧化還原反應(yīng)的溶液��,要防止在保存期間失效��。如Sn2+及Fe3+溶液應(yīng)分別放入一些Sn粒和Fe屑�。AgNO3、KMnO4���、KI等溶液應(yīng)貯于干凈的棕色瓶中����。容易發(fā)生化學(xué)腐蝕的溶液應(yīng)貯于合適的容器中。
3.分析天平不能稱量熱的物體��,有腐蝕性蒸氣或吸濕性物體必須放在密封容器內(nèi)稱量�。
4.分析天平屬精密儀器,周圍必須保持清潔����、干燥。要經(jīng)常更換里面的干燥劑�。
六、思考題
1�����、配制有明顯熱效應(yīng)的溶液時(shí)�,應(yīng)注意哪些問(wèn)題?
2����、用容量瓶配制標(biāo)準(zhǔn)溶液時(shí),是否可用托盤(pán)天平稱取基準(zhǔn)試劑���?
實(shí)驗(yàn)五 酸堿滴定
一�、實(shí)驗(yàn)?zāi)康?/B>
1、掌握酸堿滴定分析方法的原理和滴定操作的基本方法����。
2、掌握移液管���、滴定管等有關(guān)儀器的使用方法����,正確判斷滴定終點(diǎn)�����。
二���、儀器和藥品
儀器:酸式滴定管(05mL),堿式滴定管(50mL)�,移液管(10mL),錐形瓶(250mL)���,滴定管夾(蝴蝶夾)�,滴定臺(tái),洗耳球����。
藥品:HCl(未知濃度),NaOH(未知濃度)��,酚酞指示劑�,甲基橙指示劑。KHC8H4O4溶液�����,Na2B4O7溶液�����,KHC8H4O4(A.R)�����,Na2B4O7·10H2O A.R)
三��、實(shí)驗(yàn)原理
根據(jù)當(dāng)量定律�,酸堿剛好完全中和(滴定達(dá)到終點(diǎn))時(shí),酸得當(dāng)量數(shù)等于堿的當(dāng)數(shù)
H2C2O4+2NaOH=Na2C2O4+2H2O
NaOH+HCl=NacL+H2O
即 N酸V酸= N堿V堿
N酸��、N堿分別為當(dāng)量濃度,V酸����、V堿分別為消耗的酸堿得體積。因此�����,如果取一定體積某濃度待測(cè)的酸(或堿)溶液�,用標(biāo)準(zhǔn)堿(或酸)溶液滴定,達(dá)到終點(diǎn)后就可以以所用的酸溶液和堿得體積(V酸和V堿)以及標(biāo)準(zhǔn)堿(或酸)溶液的濃度����。
中和滴定的終點(diǎn)可借助于指示劑的顏色變化來(lái)確定,指示劑本身是一種弱酸或弱堿��,它們?cè)诓煌腜H范圍顯示出不同的顏色����。例如酚酞的變色范圍為PH=8.0~10.0����,在8.0以下為無(wú)色,10.0以下為紅色����,8.0~10.0之間顯淺紅色�。又如甲基橙�,變色范圍為PH=4.4~6.2,PH=4.4以下顯紅色�,6.2以上顯黃色,4.4~6.2之間顯橙色或橙紅色�����。強(qiáng)堿滴定強(qiáng)酸時(shí)�,常用酚酞溶液作指示劑。顯然�,利用指示劑的變色來(lái)確定的終點(diǎn)與酸堿中和時(shí)的等當(dāng)點(diǎn)(當(dāng)堿溶液與酸溶液中和達(dá)到二者的當(dāng)量數(shù)相同時(shí)稱等當(dāng)點(diǎn))可能不一致。如以強(qiáng)堿滴定強(qiáng)酸�����,在等當(dāng)點(diǎn)時(shí)PH應(yīng)等于7�,而用酚酞作指示劑,它的變色范圍是8.0~10.0��。這樣滴定到終點(diǎn)(溶液又無(wú)色變?yōu)榧t色)時(shí)就需要消耗一些堿���。因而���,就可能帶來(lái)滴定誤差�����。但是�����,根據(jù)計(jì)算��,這些滴定終點(diǎn)與等當(dāng)點(diǎn)不相一致所引起誤差是很小的��,對(duì)酸堿的濃度影響很小����。
四�����、實(shí)驗(yàn)內(nèi)容與步驟
一)���、用NaOH溶液濃度的標(biāo)定
1.將洗凈的堿式滴定管用NaOH標(biāo)準(zhǔn)溶液潤(rùn)洗2~3次后���,裝入NaOH標(biāo)準(zhǔn)溶液,趕走滴定管下端的氣泡�,記下液面讀數(shù)(或調(diào)整液面至“0”處)。
2.取已洗凈的10ml移液管一支����,用已知準(zhǔn)確濃度的KHC8H4O4溶液潤(rùn)洗2~3次,然后吸取10.00mL已知濃度的KHC8H4O4溶液于錐形瓶中�。加入1~2滴酚酞指示劑,此時(shí)溶液呈無(wú)色��。
3.用NaOH溶液滴定KHC8H4O4溶液至微紅色�,并且紅色在半分鐘內(nèi)不消失,即可認(rèn)為已達(dá)滴定終點(diǎn)���,記下液面讀數(shù)��。滴定前后管內(nèi)液面讀數(shù)之差即為滴定所消耗的NaOH標(biāo)準(zhǔn)溶液的體積����。
按照上述操作再滴定一次����,直到兩次滴定所用NaOH溶液的體積相差不超過(guò)0.02mL為止,取兩次結(jié)果的平均值���,求出NaOH溶液的準(zhǔn)確濃度���。
二)��、再用上述濃度已標(biāo)定出的NaOH溶液滴定未知濃度的HCl溶液
1.取已洗凈的25mL移液管一支�����,用未知濃度的HCl溶液潤(rùn)洗2~3次���,然后吸取25.00mL未知濃度的HCl溶液于錐形瓶中。加入2滴酚酞指示劑��,此時(shí)溶液呈無(wú)色����。
2.將洗凈的酸式滴定管,用濃度已標(biāo)定的NaOH標(biāo)準(zhǔn)溶液潤(rùn)洗2~3次后���,裝入NaOH標(biāo)準(zhǔn)溶液����,趕走滴定管下端的氣泡,記下液面讀數(shù)(或調(diào)整液面至“0”處)���。
3.用NaOH標(biāo)準(zhǔn)溶液滴定未知濃度的HCl溶液至黃色變?yōu)榧t色����,并在15秒鐘內(nèi)不再變?yōu)闊o(wú)�,即為滴定終點(diǎn)�����,記下液面讀數(shù)��。滴定前后管內(nèi)液面讀數(shù)之差即為滴定所消耗的NaOH標(biāo)準(zhǔn)溶液的體積�。
按照上述操作再滴定一次,直到兩次滴定所用NaOH標(biāo)準(zhǔn)溶液的體積相差不超過(guò)0.02mL為止��,取兩次結(jié)果的平均值�,求出HCl溶液的準(zhǔn)確濃度。
五�、思考題
一、下列情況對(duì)實(shí)驗(yàn)結(jié)果有何影響�����?
1.滴定管讀數(shù)時(shí),視線在液面彎月面的上方���。
2.滴定完后���,下端尖嘴外留有液滴。
3.滴定過(guò)程中�,錐形瓶搖動(dòng)太劇烈,以至有些液體飛濺出去��。
4.滴定過(guò)程中����,向錐形瓶中加入少量蒸餾水。
二��、滴定前為什么要將滴定管內(nèi)的氣泡排出�����?它對(duì)滴定結(jié)果有何影響��?
實(shí)驗(yàn)六氯化鈉的提純
一�、實(shí)驗(yàn)?zāi)康?/B>
1、學(xué)習(xí)減壓抽濾����、蒸發(fā)濃縮等基本操作�����。
2��、了解沉淀平衡原理的應(yīng)用����。
3���、學(xué)習(xí)在分離提純物質(zhì)過(guò)程中,定性檢驗(yàn)?zāi)撤N物質(zhì)是否已除去的方法�����。
二��、儀器和藥品
托盤(pán)天平�����,溫度計(jì)����,蒸發(fā)皿�,酒精燈���,玻棒���,抽濾瓶,布氏漏斗���,燒杯��。
三����、實(shí)驗(yàn)原理
氯化鈉試劑或氯堿工業(yè)用的食鹽水�����,都是以粗鹽為原料進(jìn)行提純的���。粗鹽中除了含有泥沙等不溶性雜質(zhì)外�,還含有K+���、Ca2+��、Mg2+和SO42-等可溶性雜質(zhì)��。不溶性雜質(zhì)可用過(guò)濾法除去���?����?扇苄噪s質(zhì)中的Ca2+���、Mg2+和SO42-可通過(guò)加入BaCl2�����、��、NaOH和Na2CO3溶液�,生成難溶的硫酸鹽、碳酸鹽或堿式碳酸鹽沉淀除去�;也可加入BaCO3固體和NaOH溶液進(jìn)行如下反應(yīng)除去:
BaCO3=Ba2++CO32-
Ba2++SO42-=BaSO4↓
Ca2++CO32-=CaCO3↓
Mg2++OH-=Mg(OH)4↓
上述兩種提純方法可由兩位同學(xué)合作進(jìn)行實(shí)驗(yàn),最后寫(xiě)出評(píng)述性報(bào)告���。
四����、實(shí)驗(yàn)內(nèi)容與步驟
一)、稱取20.0g粗鹽于燒杯中����,加入約70 cm3水,加熱攪拌使之溶解�����。
二)�����、除Ca2+���、Mg2+和SO42-
1.BaCl2-NaOH�,Na2CO3法
(1)除去SO42-
加熱溶液至沸����,邊攪拌邊滴加1mol·dm-3BaCl2盡為止。繼續(xù)加熱煮沸數(shù)分鐘���。過(guò)濾�。
(2)除Ca2+、Mg2+和過(guò)量的Ba2+
將濾液加熱至沸���,邊攪拌邊滴加NaOH-Na2CO3混合液至溶液pH值約等于11��。取清夜檢驗(yàn)Ba2+除盡后�,繼續(xù)加熱煮沸數(shù)分鐘����。過(guò)濾。
(3)除過(guò)量的CO32-
加熱攪拌溶液��,滴加6 mol·dm-3HCl至溶液的pH=2~3���。
2.BaCO3—NaOH法
(1)除Ca2+和SO42-
在粗食鹽水溶液中,加入約1.0g BaCO3(比SO42-和Ca2+的含量約過(guò)量10%)�����。在363K左右攪拌溶液20~30min��。取清夜�,用飽和(NH4)2C2O4檢驗(yàn)Ca2+��,如尚未除盡�,需繼續(xù)加熱攪拌溶液��,至除盡為止���。
(2)除Mg2+
用6 mol·dm-3NaOH調(diào)節(jié)上述溶液至pH為11左右�����。取其清夜����,分別加入2~3滴6 mol·dm-3NaOH和鎂試劑���,證實(shí)Mg2+除盡后�,再加熱數(shù)分鐘��,過(guò)濾�。
(3)溶液的中和
用6 mol·dm-3HCl調(diào)節(jié)溶液的pH=5~6。
三)����、蒸發(fā)����、結(jié)晶
加熱蒸發(fā)濃縮上述溶液����,并不斷攪拌至稠狀。趁熱抽干后轉(zhuǎn)入蒸發(fā)皿內(nèi)用小火烘干�����。冷至室溫�����,稱重����,計(jì)算產(chǎn)率。
四)����、產(chǎn)品質(zhì)量的檢驗(yàn)
取粗鹽和產(chǎn)品各1g左右�,分別溶于蒸餾水中。定性檢驗(yàn)溶液中是否有SO42-���、Ca2+和Mg2+的存在���,比較實(shí)驗(yàn)結(jié)果��。
五�、實(shí)驗(yàn)注意事項(xiàng)
1.檢驗(yàn)SO42-是否除盡時(shí),可將燒杯從石棉網(wǎng)上取下,取少量上層溶液過(guò)濾于小試管中,加入幾滴1mol·dm-3BaCl2溶液.如果有混濁,說(shuō)明未除盡,需要再加入1mol·dm-3BaCl2溶液.反之表示已除盡���。
2.海鹽中一般含有的(0.1-0.25)%Ca2+,含有(1.0-1.3)%的SO42-����。
3.在實(shí)驗(yàn)中�����,以Mg(OH)2沉淀形式除去粗鹽中的Mg2+時(shí)��,則應(yīng)注意控制好溶液的pH值��。
六����、思考題
1.能否用重結(jié)晶的方法提純氯化鈉?
2.能否用氯化鈣代替毒性大的氯化鋇來(lái)除去食鹽中的SO42-?
3.試用沉淀溶解平衡原理�,說(shuō)明用碳酸鋇除去食鹽中SO42-和Ca2+的根據(jù)和條件。
4.在提純粗食鹽溶液中��,K+將在哪一步除去��?
實(shí)驗(yàn)七置換法測(cè)定摩爾氣體常數(shù)
一��、實(shí)驗(yàn)?zāi)康?/p>
一���、掌握理想氣體狀態(tài)方程和氣體分壓定律的應(yīng)用��。
二�、練習(xí)測(cè)量氣體體積的操作和氣壓計(jì)的使用�����。
基本原理
活潑金屬鎂與稀硫酸反應(yīng)���,置換出棄去
Mg+H2SO4=MgSO4+H2↑
準(zhǔn)確稱取一定質(zhì)量(mMg)的金屬鎂�����,使其與過(guò)量的稀硫酸作用���,在一定溫度和壓力下,測(cè)定被置換出來(lái)的氫氣的體積(VH2),由理想氣體狀態(tài)方程式可計(jì)算出摩爾氣體常數(shù)R:
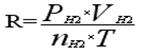
其中:PH2為氫氣的分壓��,nH2為一定質(zhì)量的金屬鎂置換出的氫氣的物質(zhì)的量��。
實(shí)驗(yàn)器材
分析天平�����,量氣管(或50 cm3堿式滴定管)���,滴定管夾�,滴定臺(tái)�,燒杯(100 cm3),橡皮管�,試管(25 cm3)液面調(diào)節(jié)管,長(zhǎng)頸漏斗����。
實(shí)驗(yàn)內(nèi)容與步驟
(1)準(zhǔn)確稱取兩份已擦去表面氧化膜的鎂條,每份質(zhì)量為0.030~0.035g(準(zhǔn)確到0.0001g)��。
(2)按圖所示裝配好儀器�����,打開(kāi)試管3的膠塞,由液面調(diào)節(jié)的往量氣管1內(nèi)裝水至低于刻度“0”的位置���。上下移動(dòng)調(diào)節(jié)管的以趕盡膠管和量氣管內(nèi)的氣泡��,然后將試管3的塞子塞緊���。
(3)檢查裝置的氣密性,把調(diào)節(jié)管2下移一段距離��,固定在燒瓶夾4上�����。如果量氣管液面只在初始時(shí)稍有下降���,以后維持不變(觀察3~5分鐘)��,即表明裝置不漏氣����。如液面不斷下降��,應(yīng)重復(fù)檢查各接口處是否嚴(yán)密,直至確證不漏氣為止�����。
(4)把液面調(diào)節(jié)管2上移回原來(lái)位置����,取下試管3���,用一長(zhǎng)頸漏斗往試管3注入6~8cm33mol·dm-3硫酸���,取出漏斗時(shí)注意切勿使硫酸沾污管壁。將試管3按一定傾斜度固定好�,把鎂條用水稍微濕潤(rùn)后貼于管壁內(nèi),確保鎂條不與硫酸接觸����,檢查量氣管內(nèi)液面是否處于“0”刻度以下,再次檢查裝置氣密性����。
(5)將調(diào)節(jié)管2靠近量氣管右側(cè),使兩管內(nèi)液面保持同一水平��,記下量氣管液面位置。將試管3底部略為提高�,讓硫酸與鎂條接觸,這時(shí)���,反應(yīng)產(chǎn)生的氫氣進(jìn)入量氣管中�����,管中的水被壓入調(diào)節(jié)管內(nèi)���。為避免量氣管內(nèi)壓力過(guò)大,可適當(dāng)下移調(diào)節(jié)管2���,使兩管液面大體保持同一水平��。
(6)反應(yīng)完畢后�����,待試管3冷至室溫��,然后使調(diào)節(jié)管2與量氣管1內(nèi)液面處于同一水平�,記錄液面位置�。1~2分鐘后再記錄液面位置�,至兩次讀數(shù)一致��,即表明管內(nèi)氣體溫度已與室溫相同����。
(7)記錄室溫和大氣壓。
問(wèn)題思考
1��、如何檢測(cè)本實(shí)驗(yàn)體系是否漏氣��?其根據(jù)是什么���?
2、讀取量氣管內(nèi)氣體體積時(shí)��,為什么要使量氣管和液面調(diào)節(jié)管中的液面保持同一水平面���?
實(shí)驗(yàn)注意事項(xiàng)
一��、注意單位及各量之間的關(guān)系:
1.PH2:(Pa )=室溫下的大氣壓-室溫時(shí)水的飽和蒸氣壓
mmHg 20℃時(shí)=23.378×102Pa
1mmHg=133.322Pa
2.VH2:(M3)=實(shí)測(cè)體積V(ml)-水蒸氣體積(可忽略)
1ml=10-6M3
3.nH2:(mol)

4.T:絕對(duì)溫度K=t℃+273.15
5.R:摩爾氣體常數(shù)Pa·M3·K-1·mol-1
二�、誤差:即準(zhǔn)確度�。指測(cè)定值與真實(shí)值相差的程度,誤差越小��,表示測(cè)量結(jié)果的準(zhǔn)確度越高。
絕對(duì)誤差=測(cè)量值-真實(shí)值(理論值)

(百分誤差):+值:測(cè)量值偏高
R的真實(shí)值=8.31Pa·M3·K-1·mol-1
-值:測(cè)量值偏低
實(shí)驗(yàn)八 二氧化碳分子量的測(cè)定
實(shí)驗(yàn)內(nèi)容
1.充滿空氣的瓶和塞子的稱量
2.充滿CO2的瓶和塞子的稱量
3.充滿水的瓶和塞子的稱重
實(shí)驗(yàn)?zāi)康?/p>
了解氣體密度法測(cè)定氣體分子量的原理和方法�����。
基本原理
根據(jù)阿佛加德羅定律���,同溫度和同壓力下同體積的各種氣體都含有相同數(shù)目的分子���,因此,在同溫同壓下兩種同體積的不同氣體的質(zhì)量之比等于它們的分子質(zhì)量之比�。可分別用下面公式表示:
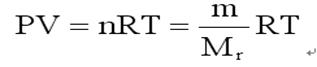
同溫�、同壓、同體積下的兩種不同氣體:

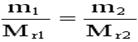 (1)
(1)
這樣���,只要在同溫同壓下���,測(cè)得一定體積的已知相對(duì)分子質(zhì)量(Mr1)的氣體的質(zhì)量(m1),又測(cè)得同體積的待測(cè)氣體的質(zhì)量(m2),便可求得待測(cè)氣體的相對(duì)分子質(zhì)量(Mr2)�。
本實(shí)驗(yàn)是在同溫同壓下,分別測(cè)定同體積的CO2和空氣(平均相對(duì)分子質(zhì)量為29.0)的質(zhì)量�,由下列公式計(jì)算CO2的相對(duì)分子量:
(2)
式中CO2的質(zhì)量mCO2是由兩次稱重求得:
第一次稱重充滿空氣的容器的質(zhì)量為G1=容器質(zhì)量+m空氣(3)
第二次稱量充滿空氣的容器的質(zhì)量為G2=容器質(zhì)量+mCO2 (4)
由(4)-(3)式得mCO2=(G2-G1)=m空氣(5)
(5)式中的空氣質(zhì)量m空氣可用理想狀態(tài)方程求算:
m空氣=29.0pV/RT(6)
式中的p和T分別為實(shí)驗(yàn)時(shí)的大氣壓力(kPa)和絕對(duì)溫度。R為氣體常數(shù)�����。V為容器的體積,它由下面的稱重求得:
假定在同溫同壓下稱重充滿水的容器的質(zhì)量為
G3=容器質(zhì)量+m水(7)
由(7)-(3)式得:G3-G1=m水-m空氣≈m水(8)
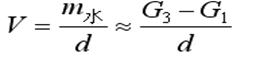 (9)
(9)
因此(9)式中的d為水的密度(1.00g/cm3)���。根據(jù)上述有關(guān)公式�,可計(jì)算CO2的相對(duì)分子量��。
實(shí)驗(yàn)器材
裝有CO2的鋼瓶����,分析天平,托盤(pán)天平�,錐形瓶(150 cm3)���,膠塞��。
實(shí)驗(yàn)步驟
(1)充滿空氣的瓶和塞子的稱量
取一個(gè)干燥的錐形瓶��,用一個(gè)合適的膠塞塞住瓶口�,在膠塞時(shí)做一記號(hào)����,以固定膠塞塞入瓶口的位置��。然后稱得質(zhì)量G1(準(zhǔn)確至0.001g)���。
(2)充滿CO2的瓶和塞子的稱量
從裝有CO2的鋼瓶中,將CO2導(dǎo)入錐形瓶底部��。待CO2充滿瓶后����,緩慢取出導(dǎo)氣管,用膠塞塞入瓶口至記號(hào)位置�,進(jìn)行稱量。再重復(fù)充CO2的操作直到前后兩次的稱量相差1到2mg為止��,記下G2����。
(3)充滿水的瓶和塞子的稱重
往錐形瓶?jī)?nèi)加滿水,塞好塞子(注意位置?���。┓Q得質(zhì)量G3。記下實(shí)驗(yàn)時(shí)的溫度T和大氣壓p(Kpa)��。
問(wèn)題思考
1.如何證實(shí)收集CO2的容器已充滿CO2?
2.充滿空氣或CO2的容器的質(zhì)量����,為什么要在分析天平上稱量,而充滿水的容器的質(zhì)量卻可在托盤(pán)天平稱量��?
實(shí)驗(yàn)注意事項(xiàng)
1.要求前后二次(CO2+瓶+塞子)的質(zhì)量相近�����,即不相差2mg�����,計(jì)算時(shí)用較重的那次質(zhì)量��。
2.為了有效排除錐形瓶中的空氣���,CO2通入的氣流要快一些為好。
3.的錐形瓶���,里邊不能有氣泡��。在臺(tái)秤稱上稱量時(shí)��,要擦干外面的水滴���。
4.利用pV=nRT����,在室溫下測(cè)定實(shí)際氣體CO2的分子量���,產(chǎn)生1~2%的誤差是合理的��。
5.本實(shí)驗(yàn)所使用的公式和定律����,弄清它們之間的關(guān)系以及它們各自的單位:
容器體積V的單位應(yīng)換算成m3��;
大氣壓p的單位應(yīng)換算成Pa���;
水的密度d=1.00g/cm3��;
摩爾氣體常數(shù)R=8.31 Pa·m3·K-1·mol-1
實(shí)驗(yàn)九 弱電解質(zhì)電離常數(shù)的測(cè)定
 實(shí)驗(yàn)內(nèi)容
實(shí)驗(yàn)內(nèi)容
一�����、HAC溶液濃度的標(biāo)定
二�����、分別測(cè)定HAC在不同濃度下溶液的PH值
實(shí)驗(yàn)?zāi)康?/p>
一�����、測(cè)定醋酸的電離常數(shù)���,加深對(duì)電離度和電離常數(shù)的理解���。
二、學(xué)習(xí)正確使PH計(jì)�����。
基本原理
醋酸(CH3COOH)簡(jiǎn)寫(xiě)成HAC���。在溶液中存在如下平衡:
HAC=H++AC-

式中的[H+] [AC-]和[HAC]分別是H+����、AC-和HAC的平衡濃度��,Ki為電離常數(shù)�。HAC溶液的總濃度可用標(biāo)準(zhǔn)NaOH濃度滴定測(cè)得。其電離出來(lái)的[H+]離子濃度���,可以在一定的溫度下��,用PH計(jì)測(cè)定HAC溶液的PH值�,再根據(jù)PH=-lg[H+]關(guān)系式計(jì)算出來(lái)��。另外�����,根據(jù)各物質(zhì)之間的濃度關(guān)系���,求出[Ac-]��,[HAC]后代入上式便可計(jì)算出該溫度下的Ki值�����,并可計(jì)算出電離度α��。
實(shí)驗(yàn)器材
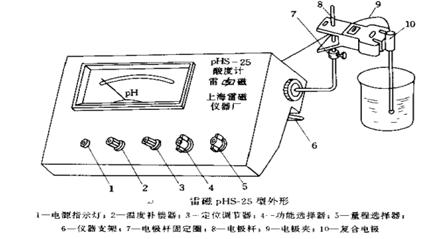
雷磁25型酸度計(jì)����,堿式滴定管(50 cm3)移液管(25 m3,10 cm3)�����,滴定管夾����,錐形瓶(250 cm3),洗耳球�,滴定臺(tái),燒杯(50 m3��,100 cm3)��,容量瓶(50 m3)��,洗瓶��,玻棒��。
圖是上海雷磁儀器廠生產(chǎn)的pHs—25型酸度計(jì)外形圖�����。
PHS—25型酸度計(jì)測(cè)定溶液pH值的步驟
1.接通電源將電源插頭插于插座中��,撥電源開(kāi)關(guān)至指示燈亮(上圖中的電源開(kāi)關(guān)在儀器背后)。儀器預(yù)熱15—20min��。
2.定位將擦干的電極插入裝有已知PH值的緩沖溶液的小燒杯中�,輕輕搖動(dòng)小燒杯��。撥“測(cè)量選擇”旋鈕調(diào)至所測(cè)PH緩沖溶液的范圍這一檔�。調(diào)節(jié)“溫度調(diào)節(jié)器”,使所指示溫度與溶液溫度相同����。調(diào)節(jié)“定位”旋鈕使電表指示該緩沖溶液準(zhǔn)確的pH值。此時(shí)定位結(jié)束���。
定位后�,定位鈕不應(yīng)再有任何變動(dòng)���。將圖中的測(cè)量選擇開(kāi)關(guān)撥至“0”檔���;功能選擇器置于中間位置。
3.測(cè)量待測(cè)液的pH值將電極從緩沖溶液中取出���,用去離子水沖洗后再用待測(cè)液淋洗�。將電極插入待測(cè)液的小燒杯中,稍稍搖動(dòng)小燒杯����。撥“測(cè)量選擇”旋鈕至相應(yīng)的pH檔。觀察電表表頭�,指針不再漂移時(shí)直接讀數(shù),此數(shù)即為待測(cè)液的pH值�。
5.收尾將測(cè)量選擇撥至“0”檔;從待測(cè)液內(nèi)取出電極�,用去離子水沖洗電極并用濾紙吸干,套上所有的帽���。用雙電極的要將玻璃電極泡在盛有去離子水的小燒杯中(但不要將甘汞電極也泡在去離子水中)���,關(guān)閉電源。
實(shí)驗(yàn)步驟
一���、用標(biāo)準(zhǔn)NaOH溶液測(cè)定HAC溶液的濃度���,用酚酞作指示劑(操作方法參照酸堿滴定實(shí)驗(yàn),終點(diǎn)應(yīng)出現(xiàn)什么顏色����?)
二�����、分別吸取2.50 cm3�,��,5.00 cm3�����,和25.00 cm3上述的HAC溶液于三個(gè)50 cm3的容量瓶中���,用蒸餾水稀釋至刻度,搖勻��,并分別計(jì)算出各溶液的準(zhǔn)確濃度�����。
三�、用四個(gè)干燥的50 cm3燒杯,分別取約30 cm3上述三種濃度的HAC溶液及未經(jīng)稀釋的HAC溶液�����,由稀到濃分別用PH計(jì)測(cè)定它們的PH值。
問(wèn)題思考
1.在醋酸溶液的平衡體系中未電離的醋酸���、醋酸根離子和氫離子的濃度是如何獲得的���?
2.在測(cè)定同一電解質(zhì)溶液的不同PH值時(shí),測(cè)定的順序?yàn)槭裁匆上〉綕猓?/p>
實(shí)驗(yàn)注意事項(xiàng)
1.若用復(fù)合電極則要取下電極下部的塑料保護(hù)帽和電極側(cè)面的膠皮帽��。
2.讀數(shù)時(shí)要注意的是所測(cè)的pH值范圍應(yīng)從右向左還是從左向右讀����。
實(shí)驗(yàn)十 

 體系平衡常數(shù)的測(cè)定
體系平衡常數(shù)的測(cè)定
實(shí)驗(yàn)?zāi)康?/p>
1.測(cè)定

 體系的平衡常數(shù),加深對(duì)化學(xué)平衡和平衡常數(shù)的理解���。
體系的平衡常數(shù),加深對(duì)化學(xué)平衡和平衡常數(shù)的理解���。
2.鞏固滴定操作��。
基本原理
碘溶解于碘化鉀溶液�,主要生成 �����。在一定溫度下���,它們建立如下平衡:
�����。在一定溫度下���,它們建立如下平衡:



其平衡常數(shù)是
 (1)
(1)
式中���, ����、[ ]���、
����、[ ]���、 分別表示各物質(zhì)的活度�����、物質(zhì)的量濃度以及活度系數(shù)。
分別表示各物質(zhì)的活度�����、物質(zhì)的量濃度以及活度系數(shù)。 越大����,表示
越大����,表示 越不穩(wěn)定,故
越不穩(wěn)定,故 又稱為
又稱為 的不穩(wěn)定常數(shù)�����。
的不穩(wěn)定常數(shù)�����。
在離子強(qiáng)度不大的溶液中�,由于

故
 (2)
(2)
為了測(cè)定上述平衡體系中各組分的濃度,可將已知濃度c的KI溶液與過(guò)量的固體碘一起搖蕩�,達(dá)到平衡后用標(biāo)準(zhǔn)Na2S2O3溶液滴定,便可求得溶液中碘的總濃度c1(即[I3-]平+[I2]平)。其中的[I2]平可用I2在純水中的飽和濃度代替�����。因此���,將過(guò)量的碘與蒸餾水一起振蕩����,平衡后用標(biāo)準(zhǔn)Na2S2O3溶液滴定�,就可以確定I2的平衡濃度[I2]平,同時(shí)也確定了[I3-]平:
 (3)
(3)
由于形成一個(gè) 離子要消耗一個(gè)I-離子���,所以平衡時(shí)I-的濃度為:
離子要消耗一個(gè)I-離子���,所以平衡時(shí)I-的濃度為:
 (4)
(4)
將[I2]平��、[I3-]平�、[I-]平代入式(2)��,便可求出該溫度下的平衡常數(shù)Kc�����。
器材和藥品
1.器材
托盤(pán)天平�����,移液管(10mL),錐形瓶(250mL),碘量瓶(100mL�����、500mL)��,酸式滴定管(50mL)����,吸耳球。
2. 藥品
I2(s), KI(0.10mol·L-1,0.200mol·L-1,0.300mol·L-1),標(biāo)準(zhǔn)Na2S2O3溶液(0.0500mol·L-1)(KI和Na2S2O3溶液必須預(yù)先標(biāo)定),淀粉溶液0.5%(m).
實(shí)驗(yàn)步驟
一�、取三個(gè)100mL干燥的碘量瓶和一個(gè)500mL碘量瓶,按表3-2所列的量配好溶液��。
二�、將上述配好的溶液在室溫下強(qiáng)烈振蕩25min����,靜置,待過(guò)量的固體I2沉于瓶底后�,取清液分析。
三���、在1-3號(hào)瓶中分別吸取上層清液10.00mL于錐形瓶中��,加入約30mL蒸餾水��,用標(biāo)準(zhǔn)Na2S2O3溶液滴定至淡黃色��,然后加入2mL淀粉溶液�,繼續(xù)滴定至藍(lán)紫色剛好消失,記下Na2S2O3消耗的體積�。
于第四號(hào)瓶中,量取出100mL清液�,以標(biāo)準(zhǔn)Na2S2O3溶液滴定記錄消耗的體積。
表3-2平衡常數(shù)測(cè)定的溶液配比
編 號(hào)
| 1
| 2
| 3
| 4
|

| 0.100
| 0.200
| 0.300
| /
|

| 50
| 50
| 50
| /
|

| 2.0
| 2.0
| 2.0
| 2.0
|

| /
| /
| /
| 250
|
注:
(1)由于碘容易揮發(fā)����,吸取清液后應(yīng)盡快滴定,不要放置太久�����,在滴定時(shí)不宜過(guò)于劇烈地?fù)u動(dòng)溶液�。
(2)本實(shí)驗(yàn)所有含碘廢液都要回收。
記錄和結(jié)果
1.列表記錄有關(guān)數(shù)據(jù)��,分別求出碘的總濃度c1和[I2]平��。
2.分別求出三種編號(hào)溶液中的[I3-]平、[I-]平以及平衡常數(shù)Kc�。
思考題
1.在固體碘和KI溶液反應(yīng)時(shí),如果碘的量不夠���,將有何影響���?碘的用量是否一定要準(zhǔn)確稱量?
2.在實(shí)驗(yàn)過(guò)程中��,如果:(1)吸取清液進(jìn)行滴定時(shí)不小心吸進(jìn)一些碘微粒����;
(2)飽和的碘水放置很久才進(jìn)行滴定;(3)振蕩的時(shí)間不夠�,對(duì)實(shí)驗(yàn)結(jié)果將產(chǎn)生什么影響?
主要參考文獻(xiàn):
1、中山大學(xué)等編��,無(wú)機(jī)化學(xué)實(shí)驗(yàn)����,北京:高等教育出版社�����,2005
2、北京師范大學(xué)無(wú)機(jī)化學(xué)教研室等編��,無(wú)機(jī)化學(xué)實(shí)驗(yàn)����,北京:高等教育出版社,2001
3�、武漢大學(xué)等編,無(wú)機(jī)化學(xué)���,北京:高等教育出版社��,1994