湖南人文科技學(xué)院
《分析化學(xué)實(shí)驗(yàn)》指導(dǎo)書(shū)
熊建龍 編著
2010年03月
第一章 分析化學(xué)實(shí)驗(yàn)基本知識(shí)
第一節(jié) 分析化學(xué)實(shí)驗(yàn)的要求
分析化學(xué)是一門(mén)實(shí)踐性很強(qiáng)的學(xué)科。分析化學(xué)實(shí)驗(yàn)與分析化學(xué)理論教學(xué)緊密結(jié)合����,是化工��、環(huán)境��、生物����、醫(yī)藥等專(zhuān)業(yè)的基礎(chǔ)課程之一。
學(xué)生通過(guò)本課程的學(xué)習(xí)�����,可以加深對(duì)分析化學(xué)基本概念和基本理論的理解�;正確和較熟練地掌握分析化學(xué)實(shí)驗(yàn)基本操作����,學(xué)習(xí)分析化學(xué)實(shí)驗(yàn)的基本知識(shí)�����,掌握典型的化學(xué)分析方法�;樹(shù)立“量”的概念,運(yùn)用誤差理論和分析化學(xué)理論知識(shí)�����,找出實(shí)驗(yàn)中影響分析結(jié)果的關(guān)鍵環(huán)節(jié)����,在實(shí)驗(yàn)中做到心中有數(shù)、統(tǒng)籌安排��,學(xué)會(huì)正確合理地選擇實(shí)驗(yàn)條件和實(shí)驗(yàn)儀器�,正確處理實(shí)驗(yàn)數(shù)據(jù),以保證實(shí)驗(yàn)結(jié)果準(zhǔn)確可靠�����;培養(yǎng)良好的實(shí)驗(yàn)習(xí)慣,實(shí)事求是的科學(xué)態(tài)度���、嚴(yán)謹(jǐn)細(xì)致的工作作風(fēng)和堅(jiān)韌不拔的科學(xué)品質(zhì)�����;提高觀察�、分析和解決問(wèn)題的能力���,為學(xué)習(xí)后續(xù)課程和將來(lái)參加工作打下良好的基礎(chǔ)���。
為了達(dá)到上述目的,對(duì)分析化學(xué)實(shí)驗(yàn)課提出以下基本要求:
1.認(rèn)真預(yù)習(xí) 每次實(shí)驗(yàn)前必須明確實(shí)驗(yàn)?zāi)康暮鸵?���,了解?shí)驗(yàn)步驟和注意事項(xiàng)�,寫(xiě)好預(yù)習(xí)報(bào)告,做到心中有數(shù)�����。
2.仔細(xì)實(shí)驗(yàn)��,如實(shí)記錄,積極思考 實(shí)驗(yàn)過(guò)程中�,要認(rèn)真地學(xué)習(xí)有關(guān)分析方法的基本操作技術(shù),在教師的指導(dǎo)下正確使用儀器����,要嚴(yán)格按照規(guī)范進(jìn)行操作。細(xì)心觀察實(shí)驗(yàn)現(xiàn)象�����,及時(shí)將實(shí)驗(yàn)條件和現(xiàn)象以及分析測(cè)試的原始數(shù)據(jù)記錄在實(shí)驗(yàn)記錄本上��,不得隨意涂改�;同時(shí)要勤于思考分析問(wèn)題,培養(yǎng)良好的實(shí)驗(yàn)習(xí)慣和科學(xué)作風(fēng)�����。
3.認(rèn)真寫(xiě)好實(shí)驗(yàn)報(bào)告 根據(jù)實(shí)驗(yàn)記錄進(jìn)行認(rèn)真整理��、分析�、歸納、計(jì)算�,并及時(shí)寫(xiě)好實(shí)驗(yàn)報(bào)告。實(shí)驗(yàn)報(bào)告一般包括實(shí)驗(yàn)名稱(chēng)�、實(shí)驗(yàn)日期��、實(shí)驗(yàn)原理����、主要試劑和儀器及其工作條件����、實(shí)驗(yàn)步驟、實(shí)驗(yàn)數(shù)據(jù)及其分析處理�、實(shí)驗(yàn)結(jié)果和討論。實(shí)驗(yàn)報(bào)告應(yīng)簡(jiǎn)明扼要�����,圖表清晰�����。
4.嚴(yán)格遵守實(shí)驗(yàn)室規(guī)則�����,注意安全 保持實(shí)驗(yàn)室內(nèi)安靜���、整潔���。實(shí)驗(yàn)臺(tái)面保持清潔,儀器和試劑按照規(guī)定擺放整齊有序�����。愛(ài)護(hù)實(shí)驗(yàn)儀器設(shè)備��,實(shí)驗(yàn)中如發(fā)現(xiàn)儀器工作不正常�����,應(yīng)及時(shí)報(bào)告教師處理�����。實(shí)驗(yàn)中要注意節(jié)約��。安全使用電�、水和有毒或腐蝕性的試劑。每次實(shí)驗(yàn)結(jié)束后�,應(yīng)將所用的試劑及儀器復(fù)原,清洗好用過(guò)的器皿�����,整理好實(shí)驗(yàn)室。
第二節(jié) 分析化學(xué)實(shí)驗(yàn)的一般知識(shí)
一���、玻璃器皿的洗滌
分析化學(xué)實(shí)驗(yàn)中使用的玻璃器皿應(yīng)潔凈透明�,其內(nèi)外壁能為水均勻地潤(rùn)濕且不掛水珠����。
(一)洗滌方法
洗滌分析化學(xué)實(shí)驗(yàn)用的玻璃器皿時(shí),一般要先洗去污物���,用自來(lái)水沖凈洗滌液�����,至內(nèi)壁不掛水珠后���,再用純水(蒸餾水或去離子水)淋洗三次。去除油污的方法視器皿而異�����,燒杯�、錐形瓶��、量筒和離心管等可用毛刷蘸合成洗滌劑刷洗。滴定管�、移液管、吸量管和容量瓶等具有精密刻度的玻璃量器��,不宜用刷子刷洗���,可以用合成洗滌劑浸泡一段時(shí)間�����。若仍不能洗凈��,可用鉻酸洗液洗滌��。洗滌時(shí)先盡量將水瀝干��,再倒入適量鉻酸洗液洗滌�����,注意用完的洗液要倒回原瓶�����,切勿倒入水池�。光學(xué)玻璃制成的比色皿可用熱的合成洗滌劑或鹽酸-乙醇混合液浸泡內(nèi)外壁數(shù)分鐘(時(shí)間不宜過(guò)長(zhǎng))。
(二)常用的洗滌劑
1.鉻酸洗液 是飽和K2Cr2O7的濃溶液�,具有強(qiáng)氧化性,能除去無(wú)機(jī)物���、油污和部分有機(jī)物�。其配制方法是:稱(chēng)取10gK2Cr2O7(工業(yè)級(jí)即可)于燒杯中���,加入約20mL熱水溶解后�����,在不斷攪拌下���,緩慢加入200mL濃H2SO4冷卻后,轉(zhuǎn)入玻璃瓶中�����,備用���。鉻酸洗液可反復(fù)使用�����,其溶液呈暗紅色�����,當(dāng)溶液呈綠色時(shí)��,表示已經(jīng)失效�,須重新配制�。鉻酸洗液腐蝕性很強(qiáng),且對(duì)人體有害����,使用時(shí)應(yīng)特別注意安全,也不可將其倒入水池�。
2.合成洗滌劑 主要是洗衣粉、洗潔精等��,適用于去除油污和某些有機(jī)物���。
3.鹽酸-乙醇溶液 是化學(xué)純鹽酸和乙醇(1:2)的混合溶液���,用于洗滌被有色物污染的比色皿、容量瓶和移液管等。
4.有機(jī)溶劑洗滌液 主要是丙酮���、乙醚����、苯或NaOH的飽和乙醇溶液�����,用于洗去聚合物����、油脂及其他有機(jī)物。
二��、實(shí)驗(yàn)室安全知識(shí)
分析化學(xué)實(shí)驗(yàn)中���,經(jīng)常使用水�����、電�����、大量易破損的玻璃儀器和一些具有腐蝕甚至易燃����、易爆或有毒的化學(xué)試劑。為確保人身和實(shí)驗(yàn)室的安全而且不污染環(huán)境����,實(shí)驗(yàn)中須嚴(yán)格遵守實(shí)驗(yàn)室的安全規(guī)則����。主要包括:
(一)禁止將食物和飲料帶進(jìn)實(shí)驗(yàn)室,實(shí)驗(yàn)中注意不用手摸臉���、眼等部位����。一切化學(xué)藥品嚴(yán)禁入口����,實(shí)驗(yàn)完畢后必須洗手。
(二)使用濃酸�、濃堿以及其他腐蝕性試劑時(shí),切勿濺在皮膚和衣物上�����。涉及濃硝酸、鹽酸����、硫酸、高氯酸�����、氨水等的操作��,均應(yīng)在通風(fēng)櫥內(nèi)進(jìn)行�����。夏天開(kāi)啟濃氨水���、鹽酸時(shí)一定先用自來(lái)水將其沖冷卻�,再打開(kāi)瓶蓋�。使用汞、汞鹽���、砷化物�、氰化物等劇毒品時(shí),要實(shí)行登記制度�,取用時(shí)要特別小心,切勿潑灑在實(shí)驗(yàn)臺(tái)面和地面上�,用過(guò)的廢物、廢液切不可亂扔�����,應(yīng)分別回收�����,集中處理�。實(shí)驗(yàn)中的其他廢物����、廢液也要按照環(huán)保的要求妥善處理。
(三)注意防火�。實(shí)驗(yàn)室嚴(yán)禁吸煙。萬(wàn)一發(fā)生火災(zāi)��,要保持鎮(zhèn)靜�����,立即切斷電源或燃?xì)庠矗⒉扇♂槍?duì)性的滅火措施�����。一般的小火用濕布�、防火布或沙子覆蓋燃燒物滅火。不溶于水的有機(jī)溶劑以及能與水起反應(yīng)的物質(zhì)如金屬鈉�����,一旦著火���,絕不能用水澆�����,應(yīng)用沙土壓或用二氧化碳滅火器滅火�����。如電器起火�,不可用水沖���,應(yīng)當(dāng)用四氯化碳滅火器滅火�。情況緊急應(yīng)立即報(bào)警。
(四)使用各種儀器時(shí)�,要在教師講解或自己仔細(xì)閱讀并理解操作規(guī)程后,方可動(dòng)手操作��。
(五)安全使用水�、電。離開(kāi)實(shí)驗(yàn)室時(shí)�,應(yīng)仔細(xì)檢查水、電�����、氣�����、門(mén)窗是否關(guān)好����。
(六)如發(fā)生燙傷和割傷應(yīng)及時(shí)處理���,嚴(yán)重者應(yīng)立即送醫(yī)院治療����。
第二章 化學(xué)分析實(shí)驗(yàn)的基本操作技術(shù)
第一節(jié) 分析天平
分析天平是定量分析工作中最重要、最常用的精密稱(chēng)量?jī)x器���。每一項(xiàng)定量分析都直接或間接地需要使用天平�,而分析天平稱(chēng)量的準(zhǔn)確度對(duì)分析結(jié)果又有很大的影響�����,因此����,我們必須了解分析天平的構(gòu)造并掌握正確的使用方法,避免因天平的使用或保管不當(dāng)影響稱(chēng)量的準(zhǔn)確度��,從而獲得準(zhǔn)確的稱(chēng)量結(jié)果��。常用的分析天平有等臂雙盤(pán)天平(包括半自動(dòng)電光天平和全自動(dòng)電光天平)和單盤(pán)天平�。這些天平在構(gòu)造上雖然有些不同,但其構(gòu)造的基本原理都是根據(jù)杠桿原理設(shè)計(jì)制造的�。
一、稱(chēng)量原理
天平是根據(jù)杠桿原理制成的�����,它用已知質(zhì)量的砝碼來(lái)衡量被稱(chēng)物體的質(zhì)量�����。

設(shè)杠桿ABC的支點(diǎn)為B(如上圖),AB和BC的長(zhǎng)度相等�,A、C兩點(diǎn)是力點(diǎn)���,A點(diǎn)懸掛的被稱(chēng)物體的質(zhì)量為P��,C點(diǎn)懸掛的砝碼質(zhì)量為Q�。當(dāng)杠桿處于平衡狀態(tài)時(shí)�,力矩相等,即: P×AB=Q×BC
因?yàn)锳B=BC�,所以P=Q,即天平稱(chēng)量的結(jié)果是物體的質(zhì)量��。
目前國(guó)內(nèi)使用最為廣泛的是半自動(dòng)電光天平��,本節(jié)對(duì)其作簡(jiǎn)單介紹���。
二、半自動(dòng)電光天平
(一)雙盤(pán)半機(jī)械加碼電光天平的構(gòu)造
電光天平是根據(jù)杠桿原理設(shè)計(jì)的��,盡管其種類(lèi)繁多��,但其結(jié)構(gòu)卻大體相同,都有底板��、立柱����、橫梁、瑪瑙刀��、刀承�、懸掛系統(tǒng)和讀數(shù)系統(tǒng)等必備部件,還有制動(dòng)器���、阻尼器�、機(jī)械加碼裝置等附屬部件�����。不同的天平其附屬部件不一定配全���。
雙盤(pán)半機(jī)械加碼電光天平的構(gòu)造如圖2-1所示����。
(二)使用方法
1.調(diào)節(jié)零點(diǎn)
電光天平的零點(diǎn)是指天平空載時(shí),微分標(biāo)尺上的“0”刻度與投影屏上的標(biāo)線相重合的平衡位置���。接通電源�,開(kāi)啟天平�����,若“0”刻度與標(biāo)線不重合�����,當(dāng)偏離較小時(shí)���,可撥動(dòng)調(diào)屏拉桿�����,移動(dòng)投影屏的位置����,使其相合�����,即調(diào)定零點(diǎn)���;若偏離較大時(shí)���,則需關(guān)閉天平,調(diào)節(jié)橫梁上的平衡螺絲(這一操作由老師進(jìn)行)�,再開(kāi)啟天平,繼續(xù)撥動(dòng)調(diào)屏拉桿���,直到調(diào)定零點(diǎn)�����,然后關(guān)閉天平��,準(zhǔn)備稱(chēng)量�����。
2.稱(chēng)量
將稱(chēng)量物放入左盤(pán)并關(guān)好左門(mén)�����,估計(jì)其大致質(zhì)量�,在右盤(pán)上放入稍大于稱(chēng)量物質(zhì)質(zhì)量的砝碼。選擇砝碼應(yīng)遵循“由大到小��,折半加入��,逐級(jí)試驗(yàn)”的原則�����。試加砝碼時(shí)�,應(yīng)半開(kāi)天平,觀察指針的偏移和投影屏上標(biāo)尺的移動(dòng)情況��。根據(jù)“指針總是偏向輕盤(pán)���,投影標(biāo)尺總是向重盤(pán)移動(dòng)”的原則���,以判斷所加砝碼是否合適以及如何調(diào)整?�?私M碼調(diào)定后�,關(guān)上右門(mén),再依次調(diào)定百毫克組及十毫克組圈碼�����,每次從折半量開(kāi)始調(diào)節(jié)。十毫克圈碼組調(diào)定后��,完全開(kāi)啟天平�����,平衡后�,從投影屏上讀出10mg以下的讀數(shù)�。克組砝碼數(shù)�、指數(shù)盤(pán)刻度數(shù)及投影屏上讀數(shù)三者之和即為稱(chēng)量物的質(zhì)量,及時(shí)將稱(chēng)量數(shù)據(jù)記錄在實(shí)驗(yàn)記錄本上��。
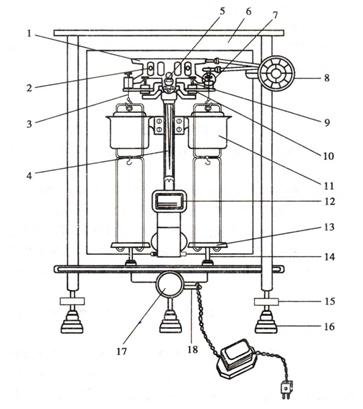
圖2-1雙盤(pán)半機(jī)械加碼電光天平
1.橫梁 2.平衡螺絲 3.吊耳 4.指針 5.支點(diǎn)刀 6.框罩 7.圈碼
8.指數(shù)盤(pán) 9.承重刀 10.折葉 11.阻尼筒 12.投影屏 13.秤盤(pán)
14.盤(pán)托 15.螺旋腳 16.墊腳 17.升降旋鈕 18.調(diào)屏拉桿
三�、分析天平的使用規(guī)則
(一)稱(chēng)量前先將天平罩取下疊好,放在天平箱上面�����,檢查天平是否處于水平狀態(tài)���,用軟毛刷清刷天平��,檢查和調(diào)整天平的零點(diǎn)����。
(二)旋轉(zhuǎn)升降旋鈕時(shí)必須緩慢,輕開(kāi)輕關(guān)��。取放稱(chēng)量物����、加減砝碼和圈碼時(shí),都必須關(guān)閉天平��,以免損壞瑪瑙刀口�。
(三)天平的前門(mén)不得隨意打開(kāi),它主要供安裝���、調(diào)試和維修天平時(shí)使用���。稱(chēng)量時(shí)應(yīng)關(guān)好側(cè)門(mén)?���;瘜W(xué)試劑和試樣都不得直接放在秤盤(pán)上,應(yīng)放在干凈的表面皿��、稱(chēng)量瓶或坩堝內(nèi)�;具有腐蝕性的氣體或吸濕性物質(zhì)�,必須放在稱(chēng)量瓶或其他適當(dāng)?shù)拿荛]容器中稱(chēng)量�����。
(四)取放砝碼必須用鑷子夾取��、嚴(yán)禁手拿����。加減砝碼和圈碼均應(yīng)遵循“由大到小����,折半加入,逐級(jí)試驗(yàn)”的原則�。旋轉(zhuǎn)指數(shù)盤(pán)時(shí),應(yīng)一檔一檔地慢慢轉(zhuǎn)動(dòng)����,防止圈碼跳落互撞。試加減砝碼和圈碼時(shí)應(yīng)慢慢半開(kāi)天平試驗(yàn)�。
(五)天平的載重不能超過(guò)天平的最大負(fù)載。在同一次實(shí)驗(yàn)中�,應(yīng)盡量使用同一臺(tái)天平和同一組砝碼,以減少稱(chēng)量誤差�����。
(六)稱(chēng)量的物體必須與天平箱內(nèi)的溫度一致,不得把熱的或冷的物體放進(jìn)天平稱(chēng)量�����。為了防潮���,在天平箱內(nèi)應(yīng)放置有吸濕作用的干燥劑��。
(七)稱(chēng)量完畢���,關(guān)閉天平,取出稱(chēng)量物和砝碼����,將指數(shù)盤(pán)撥回零位。檢查砝碼是否全部放回盒內(nèi)原來(lái)的位置和天平內(nèi)外的清潔��,關(guān)好側(cè)門(mén)����。然后檢查零點(diǎn),將使用情況登記在天平使用登記薄上��,再切斷電源,最后罩上天平罩��,將座凳放回原處��。
第二節(jié) 滴定分析的儀器和基本操作
 在滴定分析中�����,滴定管��、容量瓶���、移液管和吸量管是準(zhǔn)確測(cè)量溶液體積的量器。通常體積測(cè)量相對(duì)誤差比稱(chēng)量要大�,而分析結(jié)果的準(zhǔn)確度是誤差最大的那項(xiàng)因素所決定。因此���,必須準(zhǔn)確測(cè)量溶液的體積以得到正確的分析結(jié)果�����。溶液體積測(cè)量的準(zhǔn)確度不僅取決于所用量器是否準(zhǔn)確�,更重要的是取決于準(zhǔn)備和使用量器是否正確?�,F(xiàn)將滴定分析常用器皿及其基本操作分述如下:
在滴定分析中�����,滴定管��、容量瓶���、移液管和吸量管是準(zhǔn)確測(cè)量溶液體積的量器。通常體積測(cè)量相對(duì)誤差比稱(chēng)量要大�,而分析結(jié)果的準(zhǔn)確度是誤差最大的那項(xiàng)因素所決定。因此���,必須準(zhǔn)確測(cè)量溶液的體積以得到正確的分析結(jié)果�����。溶液體積測(cè)量的準(zhǔn)確度不僅取決于所用量器是否準(zhǔn)確�,更重要的是取決于準(zhǔn)備和使用量器是否正確?�,F(xiàn)將滴定分析常用器皿及其基本操作分述如下:
一、滴定管
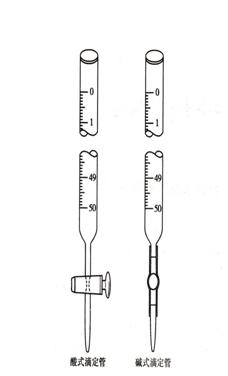
滴定管是滴定時(shí)用來(lái)準(zhǔn)確測(cè)量流出標(biāo)準(zhǔn)溶液體積的量器���。它的主要部分管身是用細(xì)長(zhǎng)而且內(nèi)徑均勻的玻璃管制成����,上面刻有均勻的分度線�,下端的流液口為一尖嘴��,中間通過(guò)玻璃旋塞或乳膠管連接以控制滴定速度�。常量分析用的滴定管標(biāo)稱(chēng)容量為50mL和25mL��,最小刻度為0.1mL���,讀數(shù)可估計(jì)到0.01mL�。
滴定管一般分為兩種:一種是酸式滴定管��,另一種是堿式滴定管(圖2-2)����。酸式滴定管的下端有玻璃活塞,可盛放酸液及氧化劑��,不宜盛放堿液。堿式滴定管的下端連接一橡皮管��,內(nèi)放一玻璃珠����,以控制溶液的流出,下面再連一尖嘴玻管�����,這種滴定管可盛放堿液�,而不能盛放酸或氧化劑等腐蝕橡皮的溶液。
滴定管的使用:
(一)洗滌:使用滴定管前先用自來(lái)水洗�,再用少量蒸餾水淋洗2-3次,每次5-6mL���,洗凈后�,管壁上不應(yīng)附著有液滴�����;最后用少量滴定用的待 圖2-2滴定管
裝溶液洗滌二次���,以免加入滴定管的待裝溶液被蒸餾水稀釋。
(二)裝液:將待裝溶液加入滴定管中到刻度“0”以上,開(kāi)啟旋塞或擠壓玻璃球�,把滴定管下端的氣泡逐出,然后把管內(nèi)液面的位置調(diào)節(jié)到刻度“0”����。排氣的方法如下:如果是酸式滴定管,可使溶液急速下流驅(qū)去氣泡����。如為堿式滴定管,則可將橡皮管向上彎曲��,并在稍高于玻璃珠所在處用兩手指擠壓��,使溶液從尖嘴口噴出���,氣泡即可除盡(如圖2-3)�����。
(三)讀數(shù):常用滴定管的容量為50mL�����,每一大格為1mL���,每一小格為0.1mL����,讀數(shù)可讀到小數(shù)點(diǎn)后兩位�。讀數(shù)時(shí),滴定管應(yīng)保持垂直��。視線應(yīng)與管內(nèi)液體凹面的最低處保持水平���,偏低偏高都會(huì)帶來(lái)誤差���。(見(jiàn)圖2-4)
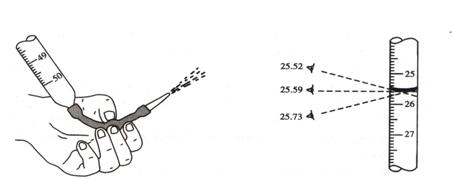
圖2-3 堿式滴定管排氣 圖2-4 目光在不同位置得到的滴定管讀數(shù)
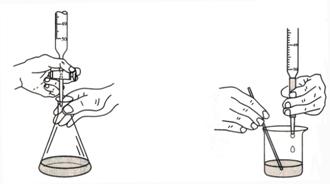 (四)滴定:滴定開(kāi)始前,先把懸掛在滴定管尖端的液滴除去����,滴定時(shí)用左手控制閥門(mén),右手持錐形瓶���,并不斷旋搖���,使溶液均勻混和���。將到滴定終點(diǎn)時(shí)����,滴定速度要慢,最后一滴一滴地滴入���,防止過(guò)量����,并且用洗瓶擠少量水淋洗瓶壁����,以免有殘留的液滴未起反應(yīng)。最后����,必須待滴定管內(nèi)液面完全穩(wěn)定后,方可讀數(shù)����。 圖2-5 滴定操作
(四)滴定:滴定開(kāi)始前,先把懸掛在滴定管尖端的液滴除去����,滴定時(shí)用左手控制閥門(mén),右手持錐形瓶���,并不斷旋搖���,使溶液均勻混和���。將到滴定終點(diǎn)時(shí)����,滴定速度要慢,最后一滴一滴地滴入���,防止過(guò)量����,并且用洗瓶擠少量水淋洗瓶壁����,以免有殘留的液滴未起反應(yīng)。最后����,必須待滴定管內(nèi)液面完全穩(wěn)定后,方可讀數(shù)����。 圖2-5 滴定操作
二、容量瓶
容量瓶主要是用來(lái)精確地配制一定體積和一定濃度的溶液的量器����,如用固體物質(zhì)配制溶液�����,應(yīng)先將固體物質(zhì)在燒杯中溶解后�����,再將溶液轉(zhuǎn)移至容量瓶中��。轉(zhuǎn)移時(shí)�����,要使玻璃棒的下端靠近瓶頸內(nèi)壁�����,使溶液沿玻棒緩緩流入瓶中����,再?gòu)南雌恐袛D出少量水淋洗燒杯及玻
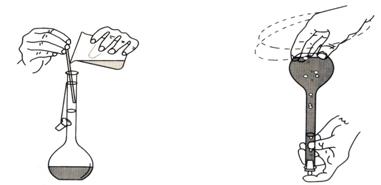
圖2-6 轉(zhuǎn)移溶液入容量瓶 圖2-7 混均操作
璃棒2-3次���,并將其轉(zhuǎn)移到容量瓶中(見(jiàn)圖2-6)����。接近標(biāo)線時(shí)��,要用滴管慢慢滴加��,直至溶液的彎月面與標(biāo)線相切為止���。塞緊瓶塞���,用左手食指按住塞子,將容量瓶倒轉(zhuǎn)幾次直到溶液混勻?yàn)橹梗ㄒ?jiàn)圖2-7)���。容量瓶的瓶塞是磨口的��,一般是配套使用��。
容量瓶不能久貯溶液�����,尤其是堿性溶液��,它會(huì)侵蝕瓶塞使其無(wú)法打開(kāi)����。也不能用火直接加熱及烘烤。使用完畢后應(yīng)立即洗凈����。如長(zhǎng)時(shí)間不用,磨口處應(yīng)洗凈檫干��,并用紙片將磨口隔開(kāi)����。
三、移液管
移液管用于準(zhǔn)確移取一定體積的溶液����。通常有兩種形狀,一種移液管中間有膨大部分�����,稱(chēng)為胖肚移液管�����;另一種是直形的�,管上有分刻度,稱(chēng)為吸量管。
移液管在使用前應(yīng)洗凈���,并用蒸餾水潤(rùn)洗3遍���。使用時(shí)���,洗凈的移液管要用被吸取的溶液潤(rùn)洗3遍�,以除去管內(nèi)殘留的水分����。吸取溶液時(shí),一般用左手拿洗耳球���,右手把移液管插入溶液中吸取��。當(dāng)溶液吸至標(biāo)線以上時(shí)���,馬上用右手食指按住管口,取出���,微微移動(dòng)食指或用大拇指和中指輕輕轉(zhuǎn)動(dòng)移液管����,使管內(nèi)液體的彎月面慢慢下降到標(biāo)線處,立即壓緊管口����;把移液管移入另一容器(如錐形瓶)中,并使管尖與容器壁接觸����,放開(kāi)食指讓液體自由流出;流完后再等15s左右�����。殘留于管尖內(nèi)的液體不必吹出�����,因?yàn)樵谛U埔汗軙r(shí)�,未把這部分液體體積計(jì)算在內(nèi)。
使用刻度吸管時(shí)�����,應(yīng)將溶液吸至最上刻度處��,然后將溶液放出至適當(dāng)刻度,兩刻度之差即為放出溶液的體積�����。
第三節(jié) 重量分析基本操作
重量分析包括揮發(fā)法����、萃取法、沉淀法��,其中以沉淀法的應(yīng)用最為廣泛��,在此僅介紹沉淀法的基本操作�。沉淀法的基本操作包括:沉淀的進(jìn)行�����,沉淀的過(guò)濾和洗滌��,烘干或灼燒���,稱(chēng)重等���。為使沉淀完全、純凈,應(yīng)根據(jù)沉淀的類(lèi)型選擇適宜的操作條件��,對(duì)于每步操作都要細(xì)心地進(jìn)行���,以得到準(zhǔn)確的分析結(jié)果����。下面主要介紹沉淀的過(guò)濾���、洗滌和轉(zhuǎn)移的基礎(chǔ)知識(shí)和基本操作����。
一��、沉淀的過(guò)濾
根據(jù)沉淀在灼燒中是否會(huì)被紙灰還原及稱(chēng)量形式的性質(zhì)��,選擇濾紙或玻璃濾器過(guò)濾��。
(一)濾紙的選擇 定量濾紙又稱(chēng)無(wú)灰濾紙(每張灰分在0.1mg以下或準(zhǔn)確已知)����。由沉淀量和沉淀的性質(zhì)決定選用大小和致密程度不同的快速、中速和慢速濾紙�����。晶形沉淀多用致密濾紙過(guò)濾,蓬松的無(wú)定形沉淀要用較大的疏松的濾紙��。由濾紙的大小選擇合適的漏斗����,放入的濾紙應(yīng)比漏斗沿低約0.5~1cm。
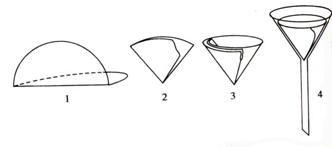
圖2-8 濾紙的折疊和安放
(二)濾紙的折疊和安放 如圖2-8所示:先將濾紙沿直徑對(duì)折成半圓(1)���,再根據(jù)漏斗的角度的大小折疊(可以大于90°�,見(jiàn)2)����。折好的濾紙�����,一個(gè)半邊為三層����,另一個(gè)半邊為單層,為使濾紙三層部分緊貼漏斗內(nèi)壁����,可將濾紙的上角撕下(3)���,并留做檫拭沉淀用。將折疊好的濾紙放在潔凈的漏斗中�,用手指按住濾紙,加蒸餾水至滿�,必要時(shí)用手指小心輕壓濾紙,把留在濾紙與漏斗壁之間的氣泡趕走�,使濾紙緊貼漏斗并使水充滿漏斗頸形成水柱,以加快過(guò)濾速度�。
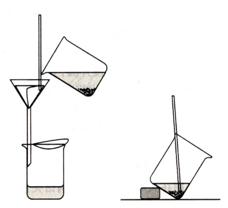 (三)沉淀的過(guò)濾 一般多采用“傾瀉法”過(guò)濾。操作如圖2-9所示:將漏斗置于漏斗之上����,接受濾液的潔凈燒杯放在漏斗下面,使漏斗頸下端在燒杯邊沿以下3~4cm處����,并與燒杯內(nèi)壁靠緊。先將沉淀傾斜靜置�,然后將上層清液小心傾入漏斗濾紙中,使清液先通過(guò)濾紙�,而沉淀盡可能地留在燒杯中,盡量不攪動(dòng)沉淀����,操作時(shí)一手拿住玻璃棒��,使與濾紙近于垂直��,玻璃棒位于三層濾紙上方�����,但不和濾紙接觸��。另一只手拿住盛沉淀的燒杯����,燒杯嘴靠住玻璃棒�����,慢慢將燒杯傾斜�,使上層清液沿著玻璃棒流入濾紙中�,隨著濾液的流注,漏斗中液體的體積增加�,至濾紙高度的2/3處,停止傾注(切勿注滿)����,停止傾注時(shí)���,可沿玻璃棒將燒杯嘴往上提一小段,扶正燒杯�����;在扶正燒杯以前不可將燒杯嘴離開(kāi)玻璃棒����,并注意不讓沾在玻璃棒上的液滴或沉淀?yè)p失,把玻璃棒放會(huì)燒杯內(nèi)�,但勿把玻璃棒靠在燒杯嘴部。 圖2-9 傾瀉法過(guò)濾操作和傾斜靜置
(三)沉淀的過(guò)濾 一般多采用“傾瀉法”過(guò)濾。操作如圖2-9所示:將漏斗置于漏斗之上����,接受濾液的潔凈燒杯放在漏斗下面,使漏斗頸下端在燒杯邊沿以下3~4cm處����,并與燒杯內(nèi)壁靠緊。先將沉淀傾斜靜置�,然后將上層清液小心傾入漏斗濾紙中,使清液先通過(guò)濾紙�,而沉淀盡可能地留在燒杯中,盡量不攪動(dòng)沉淀����,操作時(shí)一手拿住玻璃棒��,使與濾紙近于垂直��,玻璃棒位于三層濾紙上方�����,但不和濾紙接觸��。另一只手拿住盛沉淀的燒杯����,燒杯嘴靠住玻璃棒�����,慢慢將燒杯傾斜�,使上層清液沿著玻璃棒流入濾紙中�,隨著濾液的流注,漏斗中液體的體積增加�,至濾紙高度的2/3處,停止傾注(切勿注滿)����,停止傾注時(shí)���,可沿玻璃棒將燒杯嘴往上提一小段,扶正燒杯�����;在扶正燒杯以前不可將燒杯嘴離開(kāi)玻璃棒����,并注意不讓沾在玻璃棒上的液滴或沉淀?yè)p失,把玻璃棒放會(huì)燒杯內(nèi)�,但勿把玻璃棒靠在燒杯嘴部。 圖2-9 傾瀉法過(guò)濾操作和傾斜靜置
二���、沉淀的洗滌和轉(zhuǎn)移
(一)洗滌沉淀 一般也采用傾瀉法����,為提高洗滌效率�,按“少量多次”的原則進(jìn)行。即加入少量洗滌液����,充分?jǐn)嚢韬箪o置��,待沉淀下沉后��,傾瀉上層清液�����,再重復(fù)操作數(shù)次后����,將沉淀轉(zhuǎn)移到濾紙上���。
(二)轉(zhuǎn)移沉淀 在燒杯中加入少量洗滌液��,將沉淀充分?jǐn)嚻?���,立即將懸濁液一次轉(zhuǎn)移到濾紙中���。然后用洗瓶吹洗燒杯內(nèi)壁��、玻璃棒,再重復(fù)以上操作數(shù)次��;這時(shí)在燒杯內(nèi)壁和玻璃棒上可能仍殘留少量沉淀,這時(shí)可用撕下的濾紙角檫拭�,放入漏斗中。然后如圖2-10進(jìn)行最后沖洗���。
沉淀全部轉(zhuǎn)移完全后�����,再在濾紙上進(jìn)行洗滌�����,以除盡全部雜質(zhì)�����。注意在用洗瓶沖洗時(shí)是自上而下螺旋式?jīng)_洗(如圖2-11)�����,以使沉淀集中在濾紙錐體最下部��,重復(fù)多次�����,直至檢查無(wú)雜質(zhì)為止��。
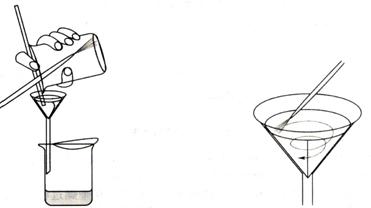
圖2-10 沉淀轉(zhuǎn)移操作 圖2-11在濾紙上洗滌沉淀
第三章 定量分析實(shí)驗(yàn)
實(shí)驗(yàn)一 酸堿標(biāo)準(zhǔn)溶液的配制及標(biāo)定
一��、實(shí)驗(yàn)?zāi)康模?/p>
1.學(xué)習(xí)酸堿標(biāo)準(zhǔn)溶液的配制���、標(biāo)定和濃度的比較��。
2.學(xué)習(xí)滴定操作�,初步掌握準(zhǔn)確地確定終點(diǎn)的方法��。
3.學(xué)習(xí)滴定分析中容量器皿等的正確使用�����。
4.熟悉指示劑色性質(zhì)和終點(diǎn)顏色的變化��。
5.學(xué)習(xí)使用分析天平及減量法��。
二��、實(shí)驗(yàn)原理:
NaOH滴定HAc���,是一個(gè)強(qiáng)堿滴定弱酸的實(shí)驗(yàn)�����,滴定的突躍范圍處于堿性����,因此選用酚酞作指示劑�,終點(diǎn)時(shí)變色敏銳。

由于氫氧化鈉易吸收空氣中的水份和二氧化碳�����,因此不能直接法配制標(biāo)準(zhǔn)溶液����,必需用基準(zhǔn)物質(zhì)進(jìn)行標(biāo)定。一般常用鄰苯二甲酸氫鉀(KHC8H4O4)作為基準(zhǔn)物質(zhì)���。此試劑易制得純品�,摩爾質(zhì)量大(204.2g/mol)��,在空氣中不易吸潮�,容易保存,是標(biāo)定堿的較好的基準(zhǔn)物質(zhì)。它與NaOH的定量反應(yīng)如下:

滴定產(chǎn)物是KNaC8H4O4����,溶液呈弱堿性。故與上面相同��,也選用酚酞作指示劑��。
標(biāo)定NaOH溶液濃度亦可用草酸(H2C2O4?2H2O)作基準(zhǔn)物質(zhì)���,與NaOH的定量反應(yīng)如下:

三����、主要試劑和儀器
1.NaOH 固體
2.HAc 0.1mol?L-1
3.酚酞 0.1%乙醇溶液
4.鄰苯二甲酸氫鉀(KHC8H4O4) 固體�,在100~125℃干燥后備用
四、實(shí)驗(yàn)步驟
1.0.1mol?L-1NaOH溶液的配制:
在臺(tái)秤上用表面皿稱(chēng)取固體NaOH1.8g~2.0g于燒杯中�,加水50mL,攪拌使之溶解�����,再加水400mL����,攪拌均勻備用�����。
2.用NaOH溶液滴定HAc:
從酸式滴定管中以每分鐘10mL的速度放出0.1mol?L-1的HAc溶液10.00~15.00mL于錐形瓶中��,加1~2滴0.1%酚酞指示劑����,用0.1mol?L-1的NaOH溶液滴定���。滴定時(shí)不停的搖動(dòng)錐形瓶,直到加入1滴或半滴NaOH溶液后��,溶液由無(wú)色變?yōu)槲⒓t色���;然后加1~2滴0.1mol?L-1的NaOH溶液���,溶液呈紅色;再由酸式滴定管中加入HAc溶液�����,使溶液變無(wú)色����;再用用0.1mol?L-1的NaOH溶液滴定至微紅色��。如此反復(fù)練習(xí)滴定操作和觀察滴定終點(diǎn)���,讀準(zhǔn)最后所用HAc和NaOH溶液的體積數(shù);并求出滴定時(shí)兩溶液的體積比VNaOH:VHAc�,平行滴定三份,直至三次測(cè)定結(jié)果的平均偏差在0.1%之內(nèi)����。
3.NaOH溶液的標(biāo)定
準(zhǔn)確稱(chēng)取鄰苯二甲酸氫鉀0.4~0.5g兩份,分別置于250mL錐形瓶中�,加水30mL使之溶解,加入1~2滴0.1%酚酞指示劑�,用NaOH溶液滴定至溶液呈微紅色,在半分鐘內(nèi)不褪色即為終點(diǎn)�����,記下每份滴定時(shí)所消耗的NaOH溶液體積���,根據(jù)消耗的NaOH體積和鄰苯二甲酸氫鉀用量即可計(jì)算NaOH溶液的準(zhǔn)確濃度��。
再根據(jù)VNaOH:VHAc�����,計(jì)算出HAc的準(zhǔn)確濃度�����。
五���、思考題
1.為什么NaOH標(biāo)準(zhǔn)溶液配制后需用基準(zhǔn)物質(zhì)進(jìn)行標(biāo)定����?
2.滴定分析中����,滴定管與移液管使用前需用所裝的溶液進(jìn)行潤(rùn)洗����,那么所用的燒杯或錐形瓶是否也要用所裝的溶液進(jìn)行潤(rùn)洗?為什么�����?
3.進(jìn)行滴定時(shí)���,滴定管讀數(shù)為什么應(yīng)從“0.00”開(kāi)始�?
4.用鄰苯二甲酸氫鉀標(biāo)定NaOH時(shí),為什么選用酚酞作指示劑�?用甲基橙或甲基紅作指示劑是偏高?
實(shí)驗(yàn)二 工業(yè)純堿總堿度的測(cè)定
一、實(shí)驗(yàn)?zāi)康?/p>
1. 了解基準(zhǔn)物質(zhì)碳酸鈉及硼砂的分子式和化學(xué)性質(zhì)�。
2. 掌握HCl標(biāo)準(zhǔn)溶液的配制、標(biāo)定過(guò)程�。
3. 掌握強(qiáng)酸滴定二元弱堿的滴定過(guò)程,突躍范圍及指示劑的選擇����。
4. 掌握定量轉(zhuǎn)移操作的基本要點(diǎn)。
二�����、實(shí)驗(yàn)原理
工業(yè)純堿的主要成分為碳酸鈉�����,商品名為蘇打����,其中可能還含有少量NaCl,Na2SO4�,NaOH及NaHCO3等成分�。常以HCl標(biāo)準(zhǔn)溶液為滴定劑測(cè)定總堿度來(lái)衡量產(chǎn)品的質(zhì)量�。滴定反應(yīng):
Na2CO3+2HCl=2NaCl+H2CO3
H2CO3=CO2↑+H2O
反應(yīng)產(chǎn)物H2CO3易形成過(guò)飽和溶液并分解為CO2逸出?�;瘜W(xué)計(jì)量點(diǎn)時(shí)溶液pH為3.8至3.9�,可選用甲基橙為指示劑,用HCl標(biāo)準(zhǔn)溶液滴定���,溶液由黃色轉(zhuǎn)變?yōu)槌壬礊榻K點(diǎn)��。試樣中NaHCO3同時(shí)被中和�。
由于試樣易吸收水分和CO2��,應(yīng)在270~300℃將試樣烘干2h��,以除去吸附水并使NaHCO3全部轉(zhuǎn)化為Na2CO3����,工業(yè)純堿的總堿度通常以w(Na2CO3)或w(Na2O)表示�����,由于試樣均勻性較差����,應(yīng)稱(chēng)取較多試樣��,使其更具代表性��。測(cè)定的允許誤差可適當(dāng)放寬一點(diǎn)�。
三���、主要試劑和儀器
1.HCl溶液 0.1mol L-1 配制時(shí)應(yīng)在通風(fēng)櫥中操作��。用量杯量取原裝濃鹽酸約9mL�,倒入試劑瓶中���,加水稀釋至1L�,充分搖勻���。
2.無(wú)水Na2CO3 于180℃干燥2~3h�����。也可將NaHCO3置于瓷坩鍋內(nèi)����,在270~300℃的烘箱內(nèi)干燥1h,使之轉(zhuǎn)變?yōu)镹a2CO3�。然后放入干燥器內(nèi)冷卻后備用。
3.甲基橙指示劑 1g·L-1�����。
4.甲基紅 2 g·L-1 60%的乙醇溶液���。
5.甲基紅-溴甲酚綠混合指示劑 將2 g·L-1甲基紅的乙醇溶液與1g·L-1溴甲酚綠乙醇溶液以1+3體積相混合��。
6.硼砂(Na2B4O7·10H2O) 應(yīng)在置有NaCl和蔗糖的飽和溶液的干燥器內(nèi)保存��,以使相對(duì)濕度為60%�,防止結(jié)晶水失去���。
四�、實(shí)驗(yàn)步驟
1.0.1mol·L-1HCl溶液的標(biāo)定
(1)用無(wú)水Na2CO3基準(zhǔn)物質(zhì)標(biāo)定 用稱(chēng)量瓶準(zhǔn)確稱(chēng)取0.15g-0.20g無(wú)水Na2CO33份�,分別倒入250mL錐形瓶中�。稱(chēng)量瓶稱(chēng)樣時(shí)一定要帶蓋,以免吸濕����。然后加入20-30mL水使之溶解�,再加入1-2滴甲基橙指示劑�����,用待標(biāo)定的HCl溶液滴定至溶液的黃色恰變?yōu)槌壬礊榻K點(diǎn)�����。計(jì)算HCl溶液的濃度�����。
(2)用硼砂Na2B4O7·10H2O標(biāo)定 準(zhǔn)確稱(chēng)取硼砂0.4~0.6g3份��,分別傾入250mL錐形瓶中��,加水50mL使之溶解���,加入2滴甲基紅指示劑�,用待標(biāo)定的HCl溶液滴定至溶液由黃色恰變?yōu)闇\紅色即為終點(diǎn)��。根據(jù)硼砂的質(zhì)量和滴定時(shí)所消耗的HCl溶液的體積�,計(jì)算HCl溶液的濃度�。
2.總堿度的測(cè)定
準(zhǔn)確稱(chēng)取試樣約2g傾入燒杯中�����,加少量水使其溶解�����,必要時(shí)可稍加熱促進(jìn)溶解���。冷卻后���,將溶液定量轉(zhuǎn)入250mL容量瓶中,加水稀釋至刻度����,充分搖勻。平行移取試液25.00mL三份于錐形瓶中��,加入1~2滴甲基橙指示劑����,用HCl標(biāo)準(zhǔn)溶液滴定溶液由黃色恰變?yōu)槌壬礊榻K點(diǎn)。計(jì)算試樣中Na2O或Na2CO3含量�����,即為總堿度��。測(cè)定的各次相對(duì)偏差應(yīng)在±0.5%以內(nèi)��。
五���、思考題
1. 為什么配制0.1mol·L-1HCl溶液1L需要量取濃HCl溶液9mL����?寫(xiě)出計(jì)算式�。
2. 無(wú)水Na2CO3保存不當(dāng),吸收了1%的水分�,用此基準(zhǔn)物質(zhì)標(biāo)定HCl溶液濃度時(shí),對(duì)其結(jié)果產(chǎn)生何種影響����?
3. 甲基橙,甲基紅及甲基紅-溴甲酚綠混合指示劑的變色范圍各為多少��?混合指示劑優(yōu)點(diǎn)是什么�?
4. 標(biāo)定HCl的兩種基準(zhǔn)物質(zhì)Na2CO3和Na2B4O7·10H2O各有那些有缺點(diǎn)?
5. 在以HCl溶液滴定時(shí)���,怎樣使用甲基橙及酚酞兩種指示劑來(lái)判別試樣是由NaOH-Na2CO3或Na2CO3-NaHCO3組成的�?
實(shí)驗(yàn)三 鉍、鉛含量的連續(xù)滴定
一��、實(shí)驗(yàn)?zāi)康?/p>
1. 了解由調(diào)節(jié)酸度提高EDTA選擇性的原理�����。
2. 掌握用EDTA進(jìn)行連續(xù)滴定的方法。
二、實(shí)驗(yàn)原理
混合離子的滴定常用控制酸度法���、掩蔽法進(jìn)行����,可根據(jù)有關(guān)副反應(yīng)系數(shù)原理進(jìn)行計(jì)算,論證對(duì)它們分別滴定的可能性����。
Bi3+,Pb2+均能與EDTA形成穩(wěn)定的1:1絡(luò)合物���,lgK分別為27.94和18.04�。由于兩者的lgK相差很大�,故可利用酸效應(yīng)����,控制不同的酸度��,進(jìn)行分別滴定�。在pH≈1時(shí)滴定Bi3+�,在pH≈5~6時(shí)滴定Pb2+。
在Bi3+~Pb2+混合溶液中�����,首先調(diào)節(jié)溶液的pH≈1���,以二甲酚橙為指示劑�����,Bi3+與指示劑形成紫紅色絡(luò)合物(Pb2+在此條件下不會(huì)與二甲酚橙形成有色絡(luò)合物)�����,用EDTA標(biāo)液滴定Bi3+�,當(dāng)溶液由紫紅色恰變?yōu)辄S色��,即為滴定Bi3+的終點(diǎn)。

在滴定Bi3+后的溶液中��,加入六亞甲基四胺溶液��,調(diào)節(jié)溶液pH=5~6�,此時(shí)Pb2+與二甲酚橙形成紫紅色絡(luò)合物,溶液再次呈現(xiàn)紫紅色�����,然后用EDTA標(biāo)液繼續(xù)滴定�,當(dāng)溶液由紫紅色恰轉(zhuǎn)變?yōu)辄S色時(shí),即為滴定Pb2+的終點(diǎn)��。

三�����、主要試劑和儀器
1. EDTA溶液���。
2. 二甲酚橙 2 g·L-1�����。
3. 六亞甲基四胺溶液 200 g·L-1�����。
4. HCl溶液 (1+1)�。
5. Bi3+,Pb2+混合液 含Bi3+���,Pb2+各約0.01 mol·L-1。稱(chēng)取48 gBi(NO3)3��,33 gPb(NO3)2����,移入含312 mL HNO3的燒杯中,在電爐上微熱溶解后��,稀釋至10L����。
四、操作步驟
Bi3+-Pb2+混合液的測(cè)定 用移液管移取25.00 mLBi3+-Pb2+溶液3份于250mL錐形瓶中�����,加入1-2滴二甲酚橙指示劑�����,用EDTA標(biāo)液滴定,當(dāng)溶液由紫紅色恰變?yōu)辄S色����,即為Bi3+的終點(diǎn)。根據(jù)消耗的EDTA體積�,計(jì)算混合液中Bi3+的含量(以g·L-1表示)。
在滴定Bi3+后的溶液中����,滴加六亞甲基四胺溶液,至呈現(xiàn)穩(wěn)定的紫紅色后�����,再過(guò)量加入5mL�,此時(shí)溶液的pH約5-6。用EDTA標(biāo)準(zhǔn)溶液滴定�,當(dāng)溶液由紫紅色恰變?yōu)辄S色,即為終點(diǎn)�����。根據(jù)滴定結(jié)果,計(jì)算混合液中Pb2+的含量(以g·L-1表示)�。
五、思考題
1. 描述連續(xù)滴定Bi3+��,Pb2+過(guò)程中�����,錐形瓶中顏色變化的情形���,以及顏色變化的原因����。
2. 為什么不用NaOH�,NaAc或NH3·H2O�����,而要用六亞甲基四胺調(diào)節(jié)pH到5~6���?
3. 本實(shí)驗(yàn)中�����,能否先在pH=5~6的溶液中��,測(cè)定Bi3+和Pb2+的合量����,然后再調(diào)整pH≈1時(shí)測(cè)定Bi3+含量。
實(shí)驗(yàn)四 水的硬度測(cè)定
一�����、實(shí)驗(yàn)?zāi)康?/p>
1. 掌握EDTA法測(cè)定水硬度的原理和方法�。
2. 了解測(cè)定水的硬度的意義和我國(guó)常用的硬度表示方法。
3. 了解金屬指示劑的特點(diǎn)��,并掌握鉻黑T和鈣指示劑的性質(zhì)�����、應(yīng)用及終點(diǎn)時(shí)顏色的變化���。
二�、實(shí)驗(yàn)原理
含有鈣鎂鹽類(lèi)的水叫硬水(硬度小于5.6度的一般可稱(chēng)軟水)�。硬度有暫時(shí)硬度和永久硬度之分。凡水中含有鈣���、鎂的酸式鈣酸鹽�,遇熱即成鈣酸鹽沉淀而失去其硬度則為暫時(shí)硬度;凡水中含有鈣�、鎂的硫酸鹽、氯化物��、硝酸鹽等所成的硬度稱(chēng)為永久硬度�����。
暫時(shí)硬度和永久硬度的總和稱(chēng)為“總硬”����。由Mg2+離子形成的硬度稱(chēng)為“鎂硬”,由Ca2+離子形成的硬度稱(chēng)為“鈣硬”����。
水的硬度表示方法有多種����,目前我國(guó)采用二種表示方法:一種是以CaO的m·mol?L-1計(jì),表示1L水中所含CaO的m·mol數(shù)�����,其硬度表示為

另一種表示方法是以度°計(jì),1硬度單位表示十萬(wàn)份水中含一份CaO�����,1°=10ppmCaO�,其硬度表示為:

式中 CEDTA—EDTA標(biāo)準(zhǔn)溶液的濃度 mol?L-1;
VEDTA—滴定時(shí)用去的EDTA標(biāo)準(zhǔn)溶液的體積�,若為滴定總硬時(shí)所用去的,則所得硬度為總硬���;若為滴定鈣硬時(shí)用去的體積����,則所得硬度為鈣硬��;
V水樣—水樣的體積(mL)�。
水中鈣鎂離子含量,可用EDTA法測(cè)定總硬度���,測(cè)定時(shí)控制溶液的酸度為pH≈10���,鉻黑T為指示劑,以EDTA標(biāo)準(zhǔn)溶液滴定水中Ca2+����、Mg2+��,由EDTA濃度和用量�,可計(jì)算出水的總硬度����。鈣硬是在溶液pH≥12時(shí),以鈣指示劑作為指示劑����,用EDTA標(biāo)準(zhǔn)溶液滴定水中Ca2+,由EDTA濃度和用量���,可算出水鈣硬����,由總硬度減去鈣硬即為鎂硬���。
三�����、主要試劑及儀器
1.NaOH 20%�;
2.HCl 1:1�����;
3.三乙醇胺 1:2���;
4.氨性緩沖溶液 pH≈10�,溶解67gNH4Cl于少量水中����,加入570mL濃氨水,用水稀釋至1升�����;
6.鈣指示劑 稱(chēng)0.5g鈣指示劑與100gNaCl研細(xì)混勻置于小廣口瓶中���,保存于干燥器中備用�;
7.鉻黑T指示劑 0.5%�,稱(chēng)0.5g鉻黑T,加入20mL三乙醇胺�,用水稀釋至100mL;
8.EDTA標(biāo)準(zhǔn)溶液0.02mol?L-1�����。
四、實(shí)驗(yàn)步驟
總硬的測(cè)定:量取澄清的水樣100mL于錐形瓶中��,加入1~2滴1:1HCl使之酸化�����,并主沸數(shù)分鐘除去CO2�,冷卻后加入1:2三乙醇胺5mL,pH≈10氨性緩沖溶液5mL��,1~3滴鉻黑T�����,搖勻�,用EDTA標(biāo)準(zhǔn)溶液滴定,溶液由紫紅色轉(zhuǎn)變?yōu)榧兯{(lán)色即為終點(diǎn)�,記下消耗EDTA體積V1。
鈣硬的測(cè)定:量取澄清的水樣100mL于錐形瓶中�����,加入20%NaOH5mL,搖勻����,再加入少許鈣指示劑�����,搖勻��,此時(shí)溶液呈淡紅色��,用EDTA標(biāo)準(zhǔn)溶液滴定至溶液呈純藍(lán)色即為終點(diǎn)���。記下消耗EDTA體積V2���。
鎂硬的確定:由總硬度減鈣硬即鎂硬。
附注
(1)若水樣不清����,則必須過(guò)濾,過(guò)濾所用的器皿和濾紙必須是干燥的��,最初的濾液須棄去���。
(2)若水中含有銅����、鋅、錳�、鐵、鋁等離子�,則會(huì)影響測(cè)定結(jié)果,可加入1%Na2S溶液1mL使Cu2+�、Zn2+等成硫化物沉淀,過(guò)濾�����。猛的干擾可加入鹽酸羥胺消除���。
(3)在氨性液中���,Ca(HCO3)2含量較高時(shí),可能慢慢析出CaCO3沉淀����,使滴定終點(diǎn)拖長(zhǎng),變色不敏銳����,所以滴定前最好將溶液酸化����,煮沸除去CO2�����,注意HCl不可多加��,否則影響滴定時(shí)溶液的pH值����。
五��、思考題:
1. 什么叫水的硬度����?水的硬度單位有幾種表示方法?
2. 用EDTA法怎么測(cè)出總硬��?用什么作指示劑����?試液的pH值應(yīng)控制在什么范圍?實(shí)驗(yàn)中是如何控制的?
3. 用EDTA法測(cè)定水的硬度時(shí)�,哪些離子存在有干擾?應(yīng)如何消除���?
實(shí)驗(yàn)五 石灰石或白云石中鈣鎂的測(cè)定
一�����、實(shí)驗(yàn)?zāi)康?/p>
1. 學(xué)習(xí)絡(luò)合滴定法測(cè)定石灰石或白云石中鈣鎂的含量�����,并進(jìn)一步掌握絡(luò)合滴定原理���。
2. 學(xué)習(xí)絡(luò)合滴定法中采用掩蔽劑消除共存離子的干擾及反應(yīng)條件。
二����、實(shí)驗(yàn)原理
石灰石、白云石的主要成分是CaCO3和MgCO3以及少量Fe��、Al�、Si等雜質(zhì),故通常不需分離即可直接滴定�����。試樣用HCl分解后,鈣鎂等以Ca2+�、Mg2+離子進(jìn)入溶液,調(diào)節(jié)試液pH為10�,用鉻黑T(或K-B)作指示劑,以EDTA標(biāo)準(zhǔn)溶液滴定試液中Ca��、Mg合量���。于另一份試液中,調(diào)節(jié)pH≥12�,Mg2+生成Mg(OH)2沉淀,用鈣指示劑作指示劑��,用EDTA標(biāo)準(zhǔn)溶液?jiǎn)为?dú)滴定Ca2+�。
由于試樣中含有少量鐵鋁等干擾雜質(zhì),所以滴定前在酸性條件下��,加入三乙醇胺掩蔽Fe3+����、Al3+,如試樣中含有銅��、鈦、鎘��、鉍等微量黑金屬�����,可加入銅試劑(DDTC)消除干擾�。
如試樣成分復(fù)雜,樣品溶解后����,可在試液中加入六次甲基四胺和銅試劑,使Fe3+��、Al3+和重金屬離子同時(shí)沉淀除去��,過(guò)濾后即可按上述方法分別測(cè)定鈣鎂����。
三、主要試劑及儀器
1.NaOH 20%�;
2.HCl 1:1;
3.三乙醇胺 1:2����;
4.鹽酸羥胺 固體�����;
5.氨性緩沖溶液 pH≈10�����,溶解67gNH4Cl于少量水中����,加入570mL濃氨水�����,用水稀釋至1升����;
6.鈣指示劑 稱(chēng)0.5g鈣指示劑與100gNaCl研細(xì)混勻置于小廣口瓶中���,保存于干燥器中備用�����;
7.鉻黑T指示劑 0.5%�,稱(chēng)0.5g鉻黑T,加入20mL三乙醇胺����,用水稀釋至100mL;
8.EDTA標(biāo)準(zhǔn)溶液 0.02mol?L-1����。
四、實(shí)驗(yàn)步驟
準(zhǔn)確稱(chēng)取0.3g試樣于燒杯中����,加水?dāng)?shù)滴潤(rùn)濕,蓋以表面皿�����,從燒杯嘴慢慢加入1:1HCl10~20mL�,加熱使之溶解,將試樣全溶后�,冷卻、定量轉(zhuǎn)移入250mL容量瓶中�����,用水稀至刻度����,搖勻����。
鈣����、鎂總量測(cè)定:用移液管吸取25.00mL試樣溶液于250mL錐形瓶中,加水20mL�����,少許鹽酸羥胺����,1:2三乙醇胺5mL,搖勻��,加入pH≈10氨性緩沖溶液10mL���,1~3滴鉻黑T,用EDTA標(biāo)準(zhǔn)溶液滴定����,溶液由紫紅色轉(zhuǎn)變?yōu)榧兯{(lán)色即為終點(diǎn)����,記下消耗EDTA體積V1���。
鈣含量的測(cè)定:另外吸取試液25.00mL于250mL錐形瓶中�,加水20mL���,少許鹽酸羥胺��,1:2三乙醇胺5mL�����,20%NaOH10mL��,少許鈣指示劑�����,搖勻���,用EDTA標(biāo)準(zhǔn)溶液滴定,溶液由紅色變?yōu)榧兯{(lán)色即為終點(diǎn),記下消耗EDTA體積V2��。
根據(jù)EDTA的濃度及二次消耗量��,可算出試樣中CaO���、MgO百分含量�����。
附注:
1. 用三乙醇胺掩蔽Fe3+��、Al3+���,必須在酸性溶液中加入,然后再行堿化��。
2. 測(cè)定鈣時(shí)�����,如試樣中有大量鎂存在�,由于Mg(OH)2沉淀吸附Ca2+,使鈣的結(jié)果偏低���,為此可加入淀粉-甘油�����、阿拉伯樹(shù)膠或糊精等保護(hù)膠��,基本上可消除吸附現(xiàn)象���,其中以糊精效果較好。5%糊精溶液的配制如下:稱(chēng)取5g糊精于100mL沸水中�,冷卻,加入20%NaOH 5mL��,攪勻���,加入3~5滴K-B指示劑����,用EDTA溶液滴至溶液呈藍(lán)色���,臨時(shí)配用�����,使用時(shí)加10~15mL于試液中�����。
五�����、思考題
1. 用酸分解石灰石或白云石試樣時(shí)應(yīng)注意什么���?實(shí)驗(yàn)中怎樣判斷試樣已分解完全�����。
2. 用EDTA法測(cè)定鈣鎂�����,加入氨性緩沖溶液和氫氧化鈉各起什么作用�?
3. 用EDTA法測(cè)定鈣鎂時(shí)����,試樣中有少量鐵鋁銅鋅等干擾?若有干擾應(yīng)如何消除�。
4. 用三乙醇胺掩蔽Fe3+����、Al3+時(shí)���,為什么要在酸性液中加入三乙醇胺后才提高溶液的pH值?
實(shí)驗(yàn)六 溴酸鉀法測(cè)定苯酚
一����、實(shí)驗(yàn)?zāi)康?/p>
1. 了解和掌握以溴酸鉀法與碘量法配合使用來(lái)間接測(cè)定苯酚的原理和方法。
2. 掌握碘量瓶的使用方法����。
3. 了解“空白試驗(yàn)”的意義和作用,學(xué)會(huì)“空白試驗(yàn)”的方法和應(yīng)用���。
二��、實(shí)驗(yàn)原理
苯酚是煤焦油的主要成分之一���,也是許多高分子材料、合成染料����、醫(yī)藥和農(nóng)藥等方面的主要原料���,還被廣泛用于消毒、殺菌����。由于苯酚的生產(chǎn)和廣泛應(yīng)用,造成環(huán)境污染����,因此對(duì)它是常規(guī)檢測(cè)的主要項(xiàng)目之一
對(duì)苯酚的測(cè)定是基于苯酚與Br2作用生成穩(wěn)定的三溴苯酚(白色沉淀):

由于上述反應(yīng)進(jìn)行較慢,而且Br2極易揮發(fā)�����,因此不能用Br2液直接滴定�,而應(yīng)用過(guò)量Br2與苯酚進(jìn)行溴代反應(yīng)。由于Br2液濃度不穩(wěn)定�,一般使用KBrO3(含有KBr)標(biāo)準(zhǔn)溶液在酸性介質(zhì)中反應(yīng)以產(chǎn)生游離Br2:

溴代反應(yīng)完畢后,過(guò)量的Br2再用還原劑標(biāo)準(zhǔn)溶液滴定�����。但是一般常用的還原性滴定劑Na2S2O3易為Br2��、Cl2等較強(qiáng)氧化劑非定量地氧化為SO42-離子����,因而不能用Na2S2O3直接滴定Br2(而且Br2易揮發(fā)損失)����。因此過(guò)量的Br2應(yīng)與過(guò)量KI作用��,置換出I2:

析出的I2再用Na2S2O3標(biāo)準(zhǔn)溶液滴定:

在這個(gè)測(cè)定中�����,Na2S2O3溶液的濃度是在與測(cè)定苯酚相同條件下進(jìn)行標(biāo)定得到的�。這樣可以減少由于Br2的揮發(fā)損失等因素而引起的誤差���。
同時(shí)��,加入的Br2量也不是由KBrO3-KBr標(biāo)準(zhǔn)溶液的用量計(jì)算獲得���,而是由空白實(shí)驗(yàn)實(shí)際測(cè)得,這樣可以減少由于Br2的揮發(fā)損失等因素而引起的誤差����。
由上述反應(yīng)可以看出,被測(cè)苯酚與滴定劑Na2S2O3間存在如下的化學(xué)計(jì)量關(guān)系:


從而可容易地確定苯酚與Na2S2O3的化學(xué)計(jì)量關(guān)系���。再由加入的Br2量(即空白試驗(yàn)消耗的Na2S2O3的量)和剩余的Br2量(滴定試樣消耗Na2S2O3的量)計(jì)算試樣中苯酚的含量��。
三��、主要試劑和儀器
1.KBrO3-KBr標(biāo)準(zhǔn)溶液  �����。
�����。
2. Na2S2O3標(biāo)準(zhǔn)溶液 0.05mol?L-1���。
3.淀粉溶液 1%���。
4.KI溶液 10%。
5.HCl 1+1�����。
四��、實(shí)驗(yàn)步驟
準(zhǔn)確吸取試液10.00mL于250mL碘量瓶中�����,再吸取10.00mL KBrO3-KBr標(biāo)準(zhǔn)溶液加入碘量瓶中���,并加入10mLHCl(1+1)溶液�,迅速加塞振蕩1~2分鐘,此時(shí)生成白色三溴苯酚沉淀和Br2��,再避光靜置5~10分鐘�����,水封����。加入10%KI溶液①10mL�,搖勻,避光靜置5~10分鐘���,水封�。用少量水沖洗瓶塞及瓶頸上附著物��,再加水10mL�;最后用Na2S2O3標(biāo)準(zhǔn)溶液滴定至淡黃色,加10滴1%淀粉溶液��,繼續(xù)滴定至藍(lán)色消失�����,即為終點(diǎn)②。記下消耗的Na2S2O3標(biāo)準(zhǔn)溶液體積V��。并同時(shí)做空白實(shí)驗(yàn)③�,消耗的Na2S2O3標(biāo)準(zhǔn)溶液體積V空。根據(jù)實(shí)驗(yàn)結(jié)果計(jì)算苯酚含量��。(mg/L)
附注:
①加KI溶液時(shí)���,不要打開(kāi)瓶塞�,只能稍松開(kāi)瓶塞�,使KI溶液沿瓶塞流入,以免Br2揮發(fā)損失�。
②三溴苯酚沉淀易包裹I2故在近終點(diǎn)時(shí),應(yīng)劇烈振蕩碘量����。
③空白實(shí)驗(yàn):即準(zhǔn)確吸取10.00mL KBrO3-KBr標(biāo)準(zhǔn)溶液加入250mL碘量瓶中,并加入15mL去離子水及6~10mLHCl(1+1)溶液���,迅速加塞振蕩1~2分鐘��,再避光靜置5分鐘�,以下操作與測(cè)定苯酚相同。
五��、思考題
1. 什么叫“空白試驗(yàn)”���?它的作用是什么�����?由空白試驗(yàn)的結(jié)果怎樣計(jì)算KBrO3-KBr標(biāo)準(zhǔn)溶液的濃度(即加入的Br2總量)��?這與通常使用基準(zhǔn)物質(zhì)標(biāo)定標(biāo)準(zhǔn)溶液有何異同���?有何優(yōu)點(diǎn)?
2. 為什么測(cè)定苯酚要在碘量瓶中進(jìn)行�����?若用錐形瓶代替碘量瓶會(huì)產(chǎn)生什么影響��?
3. 試分析溴酸鉀法測(cè)定苯酚的主要誤差來(lái)源���。
實(shí)驗(yàn)七 鐵礦中全鐵含量的測(cè)定
一、實(shí)驗(yàn)?zāi)康?/p>
1.掌握K2Cr2O7標(biāo)準(zhǔn)溶液的配制及使用。
2.學(xué)習(xí)礦石試樣的酸溶法����。
3.學(xué)習(xí)K2Cr2O7法測(cè)定鐵的原理及方法。
4.對(duì)無(wú)汞定鐵有所了解���,增強(qiáng)環(huán)保意識(shí)�。
5.了解二苯胺磺酸鈉指示劑的作用原理����。
二、實(shí)驗(yàn)原理
用HCl溶液分解鐵礦石后�,在熱HCl溶液中,以甲基橙為指示劑��,用SnCl2將Fe3+還原至Fe2+����,并過(guò)量1~2滴。經(jīng)典方法是用HgCl2氧化過(guò)量的SnCl2�����,除去Sn2+的干擾�����,但HgCl2造成環(huán)境污染,本實(shí)驗(yàn)采用無(wú)汞定鐵法���。還原反應(yīng)為
2FeCl4-+SnCl42-+2Cl-=2FeCl42-+SnCl62-
使用甲基橙指示SnCl2還原Fe3+的原理是:Sn2+將Fe3+還原完后���,過(guò)量的Sn2+可將甲基橙還原為氫化甲基橙而褪色,不僅指示了還原的終點(diǎn)��,Sn2+還能繼續(xù)使氫化甲基橙還原成N,N-二甲基對(duì)苯二胺和對(duì)氨基苯磺酸��,過(guò)量的Sn2+則可以消除���。反應(yīng)為

以上反應(yīng)為不可逆的���,因而甲基橙的還原產(chǎn)物不消耗K2Cr2O7。
HCl溶液濃度應(yīng)控制在4 mol·L-1����,若大于6 mol·L-1��,Sn2+會(huì)先將甲基橙還原為無(wú)色����,無(wú)法指示Fe3+的還原反應(yīng)�����。HCl溶液濃度低于2 mol·L-1�����,則甲基橙褪色緩慢��。
滴定反應(yīng)為:

滴定突躍范圍為0.93~1.34V,使用二苯胺磺酸鈉為指示劑時(shí)�����,由于它的條件電位為0.85V,因而需加入H3PO4使滴定生成的Fe3+生成Fe(HPO4)2-而降低Fe3+/Fe2+電對(duì)的電位���,使突躍范圍變成0.71~1.34V,指示劑可以在此范圍內(nèi)變色���,同時(shí)也消除了FeCl4-黃色對(duì)終點(diǎn)觀察的干擾�����,Sb(Ⅴ)�,Sb(Ⅲ)干擾本實(shí)驗(yàn),不應(yīng)存在��。
三��、主要試劑和儀器
1.SnCl2 100g·L-1 10 gSnCl2·2H2O溶于40mL濃熱HCl溶液中��,加水稀釋至100mL�����。
2.SnCl2 50g·L-1����。
3.H2SO4-H3PO4混酸將15mL濃H2SO4緩慢加至70mL水中,冷卻后加入15mL濃H3PO4混勻�����。
4.甲基橙 1 g·L-1���。
5.二苯胺磺酸鈉2 g·L-1���。
6.K2Cr2O7標(biāo)準(zhǔn)溶液 =0.05000 mol·L-1 將K2Cr2O7在150~180℃干燥2h,至于干燥器中冷卻至室溫�。用指定質(zhì)量稱(chēng)量法準(zhǔn)確稱(chēng)取0.6127gK2Cr2O7于小燒杯中,加水溶解����,定量轉(zhuǎn)移至250 mL容量瓶中,加水稀釋至刻度���,搖勻�����。
=0.05000 mol·L-1 將K2Cr2O7在150~180℃干燥2h,至于干燥器中冷卻至室溫�。用指定質(zhì)量稱(chēng)量法準(zhǔn)確稱(chēng)取0.6127gK2Cr2O7于小燒杯中,加水溶解����,定量轉(zhuǎn)移至250 mL容量瓶中,加水稀釋至刻度���,搖勻�����。
四�、實(shí)驗(yàn)步驟
準(zhǔn)確稱(chēng)取鐵礦石粉1.0~1.5g于250mL燒杯中�,用少量水潤(rùn)濕,加入20mL濃HCl溶液��,蓋上表面皿�����,在通風(fēng)柜中低溫加熱分解試樣����,若有帶色不溶殘?jiān)傻渭?0~30滴100 g·L-1SnCl2助溶�。試樣分解完全時(shí)�����,殘?jiān)鼞?yīng)接近白色(SiO2),用少量水吹洗表面皿及燒杯壁��,冷卻后轉(zhuǎn)移至250mL容量瓶中�����,稀釋至刻度并搖勻�����。
移取試樣溶液25.00mL于錐形瓶中�����,加8mL濃HCl溶液���,加熱近沸,加入6滴甲基橙��,趁熱邊搖動(dòng)錐形瓶邊逐滴加入100g·L-1 SnCl2還原Fe3+�����。溶液由橙變紅,再慢慢滴加50 g·L-1 SnCl2至溶液變?yōu)榈凵?��,再搖幾下直至粉色褪去。立即用流水冷卻�����,加50mL蒸餾水���,20mL硫磷混酸�����,4滴二苯胺磺酸鈉�,立即用K2Cr2O7標(biāo)準(zhǔn)溶液滴定到穩(wěn)定的紫紅色為終點(diǎn)�����,平行測(cè)定3次����,計(jì)算礦石中鐵的含量(質(zhì)量分?jǐn)?shù))。
五����、思考題
1. K2Cr2O7為什么可以直接稱(chēng)量配制準(zhǔn)確濃度的溶液��?
2. 分解鐵礦石時(shí)�,為什么要在低溫下進(jìn)行�?如果加熱至沸會(huì)對(duì)結(jié)果產(chǎn)生什么影響?
3. SnCl2還原Fe3+的條件是什么����?怎樣控制SnCl2不過(guò)量?
4. 以K2Cr2O7溶液滴定Fe2+時(shí)�,加入H3PO4的作用是什么?
實(shí)驗(yàn)八 可溶性硫酸鹽中硫的測(cè)定
一���、實(shí)驗(yàn)?zāi)康?/p>
1. 了解重量法測(cè)定硫的基本原理�。
2. 學(xué)會(huì)重量分析的基本操作����。
二、實(shí)驗(yàn)原理
將可溶性硫酸鹽試樣溶于水中����,用稀鹽酸酸化,加熱近沸,不斷攪拌下�,緩慢滴加熱BaCl2稀溶液,使生成難溶性硫酸鋇沉淀��。

硫酸鋇是典型的晶形沉淀�,因此應(yīng)完全按照晶形沉淀的處理方法,所得沉淀經(jīng)陳化后���,過(guò)濾、洗滌�����、干燥和灼燒�,最后以硫酸鋇沉淀形式稱(chēng)量,求得試樣中硫的含量��。
1. 硫酸鋇符合于定量分析的要求
(1)硫酸鋇的溶解度小����,在常溫下為1×10-5mol?L-1,在100℃時(shí)為1.3×10-5mol?L-1��,所以在常溫和100℃時(shí)每100mL溶液中僅溶解0.23~0.3mg�,不超出誤差范圍����,可以忽略不計(jì)。
(2)硫酸鋇沉淀的組成精確地與其化學(xué)式相符合�����,化學(xué)性質(zhì)非常穩(wěn)定��,因此凡含硫的化合物將其氧化成硫酸根以及鋇鹽中的鋇離子都可用硫酸鋇的形式來(lái)測(cè)定�����。
2. 鹽酸的作用
(1)利用鹽酸提高硫酸鋇沉淀的溶解度��,以得到較大晶粒的沉淀��,利于過(guò)濾沉淀�����。由實(shí)驗(yàn)得知�����,在常溫下BaSO4的溶解度約為
鹽酸濃度(mol?L-1)
| 0.1
| 0.5
| 1.0
| 2.0
|
溶解度(mg?L-1)
| 10
| 47
| 87
| 101
|
所以在沉淀硫酸鋇時(shí)�,不要使酸度過(guò)高�,最適宜是在0.1mol?L-1以下(約0.05mol?L-1)的鹽酸溶液中進(jìn)行��,即可將硫酸鋇的溶解量忽略不計(jì)�。
(2)在0.05mol?L-1鹽酸濃度下,溶液中若含有草酸根��、磷酸根��、碳酸根與鋇離子不能發(fā)生沉淀���,因此不會(huì)干擾���。
(3)可防止鹽類(lèi)的水解作用��,如有微量鐵��、鋁等離子存在�,在中性溶液中將因水解而生成堿式硫酸鹽膠體微粒與硫酸鋇一同沉出,實(shí)驗(yàn)證明����,溶液的酸度增大,使三價(jià)離子共沉淀作用有顯著的減小�。
3. 硫酸鋇沉淀的灼燒
硫酸鋇沉淀不能立即高溫灼燒����,因?yàn)闉V紙?zhí)蓟髮?duì)硫酸鋇沉淀有還原作用:

應(yīng)先以小火使帶有沉淀的濾紙慢慢灰化變黑��,而絕不可著火�,如不慎著火,應(yīng)立即蓋上坩堝蓋使其熄滅����,否則除發(fā)生反應(yīng)外,尚能由于熱空氣流而吹走沉淀�,必須特別注意。
如已發(fā)生還原作用���,微量的硫化鋇在充足空氣中�����,可能氧化而重新成為硫酸鋇:

若能灼燒達(dá)到恒重的沉淀���,即上述氧化作用已告結(jié)束,沉淀已不含硫化鋇��。另外�����,灼燒沉淀的溫度應(yīng)不超過(guò)800℃,且不宜時(shí)間太長(zhǎng)���,以避免發(fā)生下列反應(yīng):

而引起誤差����,使結(jié)果偏低��。
三�����、主要試劑及儀器
1.鹽酸 2mol?L-1���。
2.氯化鋇 10%。
3.硝酸銀 0.1mol?L-1�����。
四�、實(shí)驗(yàn)步驟
準(zhǔn)確稱(chēng)取在100~200℃干燥過(guò)的試樣0.3g左右兩份,分別置于400mL燒杯中��,用水50mL溶解,加入2mol?L-1鹽酸6mL����,加水稀釋到約200mL,蓋上表面皿加熱近沸���。
另取10%氯化鋇溶液10mL兩份���,分別置于100mL燒杯中,加水40mL�,加熱至沸。在不斷攪拌下���,趁熱用滴管吸取稀氯化鋇溶液����,逐滴加入試液中��,沉淀作用完畢后��,靜置2min��,待硫酸鋇下沉����,于上層清液中加1~2滴氯化鋇溶液����,仔細(xì)觀察有無(wú)渾濁出現(xiàn)�����,以檢驗(yàn)沉淀是否完全�,蓋上表面皿微沸10min,在室溫下陳化12小時(shí)���,以使試液上面懸浮微小晶粒完全沉下�����,溶液澄清���。
過(guò)濾:取中速定量濾紙兩張,按漏斗的大小折好濾紙使其與漏斗很好地貼合(見(jiàn)第二章第三節(jié))����,以去離子水潤(rùn)濕���,并使漏斗頸內(nèi)留有水柱�,將漏斗置于漏斗架上,漏斗下面各放一只清潔的燒杯�,利用傾瀉法小心地把上層清液沿玻璃棒慢慢傾入已準(zhǔn)備好的漏斗中,盡可能不讓沉淀倒入漏斗濾紙上���,以免防礙過(guò)濾和洗滌�。當(dāng)燒杯中清液已經(jīng)傾注完后����,用熱水洗沉淀4次(傾瀉法),然后將沉淀定量轉(zhuǎn)移到濾紙上�,再用熱水洗滌7~8次,用硝酸銀檢驗(yàn)不顯渾濁(表示無(wú)氯離子)為止����。沉淀洗凈后,將盛有沉淀的濾紙折疊成小包����,移入已在800℃灼燒至恒重的瓷坩堝中烘干,灰化后再置于800℃的馬弗爐中灼燒1小時(shí)����,取出���,置于干燥器內(nèi)冷卻至室溫、稱(chēng)量����。根據(jù)所得硫酸鋇量,計(jì)算試樣中w(S)�、w(SO42-)以及w(Na2SO4)。
五��、思考題
1. 沉淀硫酸鋇時(shí)為什么要在稀溶液�����,稀鹽酸介質(zhì)中進(jìn)行沉淀�?攪拌的目的是什么?
2. 為什么沉淀硫酸鋇要在熱溶液中進(jìn)行而在冷卻后進(jìn)行過(guò)濾���,沉淀后為什么要陳化����?
3. 用傾瀉法過(guò)濾有什么優(yōu)點(diǎn)���?
實(shí)驗(yàn)九 鄰二氮菲吸光光度法測(cè)定鐵
(條件試驗(yàn)和試樣中鐵含量的測(cè)定)
二���、實(shí)驗(yàn)?zāi)康?/p>
1. 學(xué)習(xí)如何選擇吸光光度分析的實(shí)驗(yàn)條件。
2. 掌握用吸光光度法測(cè)定鐵的原理及方法�����。
3. 掌握分光光度計(jì)和吸量管的使用方法�。
三、實(shí)驗(yàn)原理
鐵的吸光光度法所用的顯色劑較多���,有鄰二氮菲(又稱(chēng)鄰菲啰啉��,菲繞林)及其衍生物����、磺基水楊酸�、硫氰酸鹽、5-Br-PADAP等��。其中鄰二氮菲分光光度法的靈敏度高�,穩(wěn)定性好,干擾容易消除��,因而是目前普遍采用的一種方法。
在pH為2~9的溶液中���,F(xiàn)e2+與鄰二氮菲(Phen)生成穩(wěn)定的橘紅色絡(luò)合物
Fe(Phen)32+:
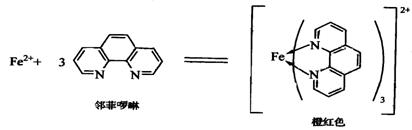
其中l(wèi)gβ3=21.3�,摩爾吸光系數(shù)ε508=1.1×104L·mol-1·cm-1����。當(dāng)鐵為+3價(jià)時(shí),可用鹽酸羥胺還原:

Cu2+��、Co2+�、Ni2+、Cd2+����、Hg2+、Mn2+���、Zn2+等離子也能與Phen生成穩(wěn)定絡(luò)合物��,在少量情況下����,不影響Fe2+的測(cè)定���,量大時(shí)可用EDTA隱蔽或預(yù)先分離�����。
吸光光度法的實(shí)驗(yàn)條件����,如測(cè)量波長(zhǎng)��,溶液酸度����、顯色劑用量、顯色時(shí)間���、溫度���、溶劑以及共存離子干擾及其消除等,都是通過(guò)實(shí)驗(yàn)來(lái)確定的���。本實(shí)驗(yàn)在測(cè)定試樣中鐵含量之前�����,先做部分條件試驗(yàn)��,以便初學(xué)者掌握確定實(shí)驗(yàn)條件的方法���。
條件試驗(yàn)的簡(jiǎn)單方法是:變動(dòng)某實(shí)驗(yàn)條件��,固定其余條件�,測(cè)得一系列吸光度值�����,繪制吸光度-某實(shí)驗(yàn)條件的曲線��,根據(jù)曲線確定某實(shí)驗(yàn)條件的適宜值或適宜范圍��。
四�����、主要試劑及儀器
1. 分光光度計(jì)���,pH計(jì)�����,50mL容量瓶8個(gè)(或比色管8支)
2. 鐵標(biāo)準(zhǔn)溶液 100 μg·mL-1準(zhǔn)確稱(chēng)取0.8634 gAR NH4Fe(SO4)2·12H2O于200mL
燒杯中���,加入20mL 6mol·L-1HCl溶液和少量水�,溶解后轉(zhuǎn)移至1L容量瓶中��,稀釋至刻度���,搖勻���。
3. 鄰二氮菲 1.5 g·L-1����。
4. 鹽酸羥胺 100 g·L-1(用時(shí)配制)。
5. NaAc 1mol·L-1����。
6. NaOH 1 mol·L-1。
7. HCl 6 mol·L-1�。
五、實(shí)驗(yàn)步驟
1. 條件試驗(yàn)
(1)吸收曲線的制作和測(cè)量波長(zhǎng)的選擇 用吸量管吸取0.0mL和1.0mL鐵標(biāo)準(zhǔn)溶液分別注入兩個(gè)50mL容量瓶(或比色管)中�����,各加入1mL鹽酸羥胺溶液,搖勻����。再加入2mL Phen,5mL NaAc���,用水稀釋至刻度�,搖勻���。放置10min后�,用1cm比色皿��,以試劑空白(即0.0mL鐵標(biāo)準(zhǔn)溶液)為參比溶液��,在440~560nm之間�,每隔10nm測(cè)一次吸光度,在最大吸收峰附近����,每隔5nm測(cè)量一次吸光度。在坐標(biāo)紙上�,以波長(zhǎng)λ為橫坐標(biāo),吸光度A為縱坐標(biāo)��,繪制A與λ關(guān)系的吸收曲線。從吸收曲線上選擇測(cè)定Fe的適宜波長(zhǎng)��,一般選用最大吸收波長(zhǎng)λmax����。
(2)溶液酸度的選擇 取8個(gè)50mL容量瓶(或比色管),用吸量管分別加入1mL鐵標(biāo)準(zhǔn)溶液�����,1mL鹽酸羥胺��,搖勻�����,再加入2mL Phen���,搖勻。用5mL吸量管分別加入0.0mL����,0.2 mL,0.5mL����,1.0mL��,1.5mL����,2.0mL�,2.5mL和3.0mL 1mol·L-1NaOH溶液,用水稀釋至刻度�,搖勻。放置10min����。用1cm比色皿,以蒸餾水為參比溶液�,在選擇的波長(zhǎng)下測(cè)定各溶液的吸光度。同時(shí)���,用pH計(jì)測(cè)量各溶液的pH����。以pH為橫坐標(biāo)�,吸光度A為縱坐標(biāo),繪制A與pH關(guān)系的酸度影響曲線,得出測(cè)定鐵的適宜酸度范圍��。
(3)顯色劑用量的選擇 取7個(gè)50mL容量瓶(或比色管)����,用吸量管各加入1mL鐵標(biāo)準(zhǔn)溶液,1 mL鹽酸羥胺�����,搖勻����,再分別加入0.1mL,0.3mL��,0.5mL�,0.8mL,1.0mL�����,2.0mL���,4.0mL Phen和5mL NaAc溶液,以水稀釋至刻度,搖勻���。放置10min���。用1cm比色皿,以蒸餾水為參比溶液����,在選擇的波長(zhǎng)下測(cè)定各溶液的吸光度。以所取Phen溶液體積V為橫坐標(biāo)�����,吸光度A為縱坐標(biāo)����,繪制A與V關(guān)系的顯色劑用量影響曲線。得出測(cè)定鐵時(shí)顯色劑的最適宜用量��。
(4)顯色時(shí)間 在一個(gè)50mL容量瓶(或比色管)中���,用吸量管加入1mL鐵標(biāo)準(zhǔn)溶液��,1mL鹽酸羥胺��,搖勻�����。再加入2mL Phen���,5mL NaAc溶液�,以水稀釋至刻度����,搖勻。立刻用1cm比色皿����,以蒸餾水為參比溶液,在選定的波長(zhǎng)下測(cè)量吸光度���。然后依次測(cè)量放置5min�,10min����,30min,60min�,120min,……后的吸光度����。以時(shí)間t為橫坐標(biāo),吸光度A為縱坐標(biāo)����,繪制A與t關(guān)系的顯色時(shí)間影響曲線。得出鐵與鄰二氮菲顯色反應(yīng)完全所需要的適宜時(shí)間����。
2. 鐵含量的測(cè)定
(1)標(biāo)準(zhǔn)曲線的制作 用移液管吸取10mL 100μg·mL-1鐵標(biāo)準(zhǔn)溶液于100mL容量瓶中,加入2mL 6mol·mL-1HCl溶液�����,用水稀釋至刻度�,搖勻。此溶液Fe3+的濃度為10μg·mL-1����。
在6個(gè)50mL容量瓶(或比色管)中,用吸量管分別加入0.00mL�����,2.00mL,4.00mL�,6.00mL,8.00mL�,10.00mL 10μg·mL-1鐵標(biāo)準(zhǔn)溶液,均加入1mL鹽酸羥胺��,搖勻�。再加入2mL Phen,5mLNaAc溶液���,搖勻�����。用水稀釋至刻度�,搖勻后放置10min���。用1cm比色皿����,以試劑空白(即0.00mL鐵標(biāo)準(zhǔn)溶液)為參比溶液���,在所選擇的波長(zhǎng)下��,測(cè)量各溶液的吸光度�。以含鐵量為橫坐標(biāo)�,吸光度A為縱坐標(biāo),繪制標(biāo)準(zhǔn)曲線���。
由繪制的標(biāo)準(zhǔn)曲線�����,重新查出某一適中鐵濃度相應(yīng)的吸光度�����,計(jì)算Fe2+-Phen絡(luò)合物的摩爾吸光系數(shù)ε��。
(2)試樣中鐵含量的測(cè)定 準(zhǔn)確吸取適量試液于50mL容量瓶(或比色管)中�����,按標(biāo)準(zhǔn)曲線的制作步驟�,加入各種試劑��,測(cè)量吸光度����。從標(biāo)準(zhǔn)曲線上查出和計(jì)算試液中鐵的含量(單位為μg·mL-1)��。
六����、思考題
1. 本實(shí)驗(yàn)量取各種試劑時(shí)應(yīng)采用何種量器較為合適���?為什么�����?
2. 試對(duì)所做條件試驗(yàn)進(jìn)行討論并選擇適宜的測(cè)量條件����。
3. 怎樣用吸光光度法測(cè)定水樣中的全鐵(總鐵)和亞鐵的含量��?試擬出一簡(jiǎn)單步驟����。
4. 制作標(biāo)準(zhǔn)曲線和進(jìn)行其它條件試驗(yàn)時(shí),加入試劑的順序能否任意改變���?為什么�����?
實(shí)驗(yàn)十 熟料水泥全分析
一 實(shí)驗(yàn)?zāi)康?/B>
1����、掌握配位滴定法的基本原理�����;
2��、學(xué)會(huì)并正確運(yùn)用配位滴定法對(duì)熟料水泥進(jìn)行全分析�;
3、正確紀(jì)錄實(shí)驗(yàn)數(shù)據(jù)���,掌握實(shí)驗(yàn)數(shù)據(jù)處理的一般方法和技巧���。
二 實(shí)驗(yàn)學(xué)時(shí):10學(xué)時(shí)
三 實(shí)驗(yàn)提示
熟料水泥的主要化學(xué)成分為SiO2,F(xiàn)e2O3��,Al2O3�����,MgO和CaO。其中SiO2可用容量法或重量法測(cè)定����,若采用重量法測(cè)定,試樣用酸分解后����,即可析出無(wú)定形硅酸沉淀,但沉淀不完全�,而且吸附嚴(yán)重。本實(shí)驗(yàn)是將試樣與7~8倍固體NH4Cl混勻后���,再加HCl分解試樣��。此時(shí)����,由于是在含有大量電解質(zhì)的小體積溶液中析出硅酸���,有利于硅酸的凝聚��,沉淀也較完全��。硅酸的含水量少�����,結(jié)構(gòu)緊密��,吸附現(xiàn)象也有所減少��。試樣分解完全后����,加適量的水溶解可溶性鹽類(lèi),過(guò)濾����,將沉淀灼燒稱(chēng)量�,即可測(cè)得SiO2的含量。
水泥熟料中的鐵����、鋁、鈣����、鎂等組分以離子形式存在于濾去SiO2沉淀的濾液中,它們都與EDTA形成穩(wěn)定的絡(luò)離子,但這些絡(luò)離子的穩(wěn)定性有較明顯的差別��。因此控制適當(dāng)?shù)乃岫染涂捎肊DTA分別滴定它們�����。調(diào)節(jié)溶液的pH值為1.8~2.2����,以磺基水楊酸作指示劑,用EDTA滴定Fe3+離子���,然后加入一定量過(guò)量的EDTA�,煮沸����,待Al3+離子與EDTA完全絡(luò)合后,再調(diào)節(jié)溶液的pH≈4.2���,以PAN作指示劑�����,用CuSO4標(biāo)準(zhǔn)溶液滴定過(guò)量的EDTA��,從而分別測(cè)得Fe2O3和Al2O3的含量�����。濾液中的Ca2+離子和Mg2+離子����,按常法用三乙醇胺掩蔽Fe3+和Al3+離子后在pH≈10時(shí)用EDTA滴定,測(cè)得鈣和鎂的總量�����;另取一份濾液在pH>12時(shí)����,用EDTA滴定鈣的含量,然后計(jì)算試樣中CaO和MgO的含量�。
四 實(shí)驗(yàn)試劑與儀器
1�、試劑
(1)鈣指示劑:鈣指示劑與NaCl以1∶100混合磨勻。
(2)磺基水楊酸(10%):10g指示劑溶于100mL水中��。
(3)PAN指示劑(0.3%):0.3g指示劑溶于100mL乙醇中��。
(4)KB指示劑:1g酸性鉻藍(lán)K�����,2g萘酚綠B與25gNaCl研細(xì)混勻。
(5)鉻黑T指示劑:絡(luò)黑T指示劑與NaCl以1∶100混合磨勻�����。
(6)金屬鋅基準(zhǔn)物:取無(wú)砷的鋅�����,先以6 mol·L-1HCl洗滌���,再用蒸餾水沖洗����,最后用丙酮洗一次�,于100℃烘干。
(7)氨緩沖溶液(pH≈10):27gNH4Cl溶于適量水中�,加濃氨水197mL,稀釋至500mL�����。
(8)HAcNaAc緩沖溶液(pH≈42):32g無(wú)水NaAc溶于水中����,加入50mL冰醋酸�,用水稀釋至1L�。
(9)三乙醇胺(25%):75%三乙醇胺350mL用水稀釋至1L。
(10)酒石酸鉀鈉(5%):50g酒石酸鉀鈉溶于水��,稀釋至1L��。
(11)濃鹽酸(密度1.19kg/L)
(12)HCl溶液(6mol·L-1):濃HCl與水等體積混合均勻��。
(13)濃HNO3(密度1.42)
(14)氨水(1∶1):濃氨水與水等體積混合均勻�。
(15)AgNO3溶液(0.1 mol·L-1):1.7gAgNO3溶于100mL水中。
(16)NH4Cl(固體)
(17)NaOH溶液(6 mol·L-1):240gNaOH溶于1L水中��。
(18)硫酸(1∶1):濃硫酸與水等體積混合均勻�����。
(19)EDTA(0.01 mol·L-1)標(biāo)準(zhǔn)溶液:稱(chēng)取4gEDTA二鈉鹽溶于溫水中����,用水稀釋至1L����。于pH≈10的氨緩沖溶液中�,以鉻黑T為指示劑��,用鋅作基準(zhǔn)物�����,標(biāo)定EDTA溶液的準(zhǔn)確濃度���。
(20)CuSO4標(biāo)準(zhǔn)溶液(0.01 mol·L-1):1.3gCuSO4·5H2O溶于水中�����,加4~5滴1∶1硫酸���,用水稀釋至0.5L。然后�,用下述方法測(cè)定CuSO4標(biāo)準(zhǔn)溶液對(duì)0.01mol·L-1EDTA標(biāo)準(zhǔn)溶液的體積比。
2���、儀器
電子天平���、常規(guī)定量分析儀器等
五 實(shí)驗(yàn)要求與預(yù)期目標(biāo)
1、查閱有關(guān)文獻(xiàn)���,設(shè)計(jì)并確定一種可行的分析實(shí)驗(yàn)方案�;
2、完成實(shí)驗(yàn)內(nèi)容����,正確紀(jì)錄實(shí)驗(yàn)數(shù)據(jù),并對(duì)實(shí)驗(yàn)數(shù)據(jù)進(jìn)行正確的處理與分析�;
3、提交完整的研究報(bào)告1份(3000-4000字)�。
六 思考題
1、熟料水泥全分析的基本原理是什么���?
2��、熟料水泥全分析具有什么意義����?
3���、本實(shí)驗(yàn)中�����,哪些物質(zhì)是掩蔽劑����?
七 參考文獻(xiàn)
1�、武漢大學(xué)分析教研室編.分析化學(xué)實(shí)驗(yàn).北京:高等教育出版社,2001第四版�����;
2����、蔡炳新陳貽文.基礎(chǔ)化學(xué)實(shí)驗(yàn).北京:科學(xué)出版社,2001第一版;
3�、其他(例如下面).
實(shí)驗(yàn)十一 三氯化六氨合鈷的制備和組成測(cè)定
實(shí)驗(yàn)?zāi)康?/p>
(1)掌握三氯化六氨合鈷(Ⅲ)的制備方法。
(2)加深對(duì)多氧化態(tài)金屬離子電對(duì)�、電極電勢(shì)變化的理解。
(3)了解沉淀滴定法和碘量法��。
實(shí)驗(yàn)原理
在水溶液中�,電對(duì)Co(Ⅲ)/Co(Ⅱ)的相應(yīng)電極電勢(shì)分別為φAθ=1.84V及φBθ=0.17V,因而在通常情況下�,水溶液中Co(Ⅱ)是穩(wěn)定的。按照配位理論�,六配位八面體場(chǎng)中,d6構(gòu)型的Co3+在強(qiáng)場(chǎng)中的穩(wěn)定化能要比d7構(gòu)型的Co2+大,因而它們的六配位配合物往往是3價(jià)穩(wěn)定性高于2價(jià)穩(wěn)定性����。或者說(shuō)��,生成六配位的低自旋配合物后��,增加了Co2+的還原性���。以鈷的六氨配合物為例�, =0.1V��,說(shuō)明在水合狀態(tài)下不穩(wěn)定的Co3+離子變?yōu)榘迸浜衔锖蠓€(wěn)定性大為提高��。事實(shí)上���,空氣中的氧即可將[Co(NH3)6]2+氧化為[Co(NH3)6]3+:
=0.1V��,說(shuō)明在水合狀態(tài)下不穩(wěn)定的Co3+離子變?yōu)榘迸浜衔锖蠓€(wěn)定性大為提高��。事實(shí)上���,空氣中的氧即可將[Co(NH3)6]2+氧化為[Co(NH3)6]3+:
2[Co(NH3)6]2++1/2O2+H2O=2[Co(NH3)6]3++2OH-
但在實(shí)際制備中����,很少用鼓空氣于體系中的方法來(lái)進(jìn)行氧化過(guò)程�,這主要是因?yàn)榘钡膿]發(fā)性的緣故。常使用不致引入雜質(zhì)的H2O2作氧化劑�。
本實(shí)驗(yàn)利用活性炭的選擇催化作用,在有過(guò)量氨和氯化銨存在下,以過(guò)氧化氫為氧化劑氧化Co(Ⅱ)溶液�����,制備標(biāo)題化合物:
2[Co(H2O)]Cl2+10NH3+2NH4Cl+H2O2=2[Co(NH3)6]Cl3+4H2O
為了除去產(chǎn)物中混有的催化劑����,可將產(chǎn)物溶解在酸性溶液中���,過(guò)濾除去活性炭���,然后在高濃度鹽酸存在下使產(chǎn)物結(jié)晶析出。
三氯化六氨合鈷(Ⅲ)為橙黃色單斜晶體����,293K下在水中飽和溶解度為0.26 mol·L-1。在水溶液中���,K不穩(wěn)=2.2×10-34���;在室溫下基本不為強(qiáng)堿或強(qiáng)酸所破壞,只有在煮沸的條件下����,才為過(guò)量強(qiáng)堿以下式所分解��。
2[Co(NH3)6]Cl3+6NaOH=2Co(OH)3+12NH3+6NaCl
本實(shí)驗(yàn)利用上述反應(yīng)對(duì)配合物的組成進(jìn)行測(cè)定:①用過(guò)量標(biāo)準(zhǔn)酸吸收反應(yīng)中逸出的氨��,再用標(biāo)準(zhǔn)堿反滴剩余的酸��,從而測(cè)定出氨的含量����;②過(guò)濾出Co(OH)3后�,濾液中的Cl-與Ag+標(biāo)準(zhǔn)溶液作用,定量生成AgCl沉淀�����,由Ag+標(biāo)準(zhǔn)溶液的消耗量可以確定樣品中Cl-的含量���;③濾出的鈷(Ⅲ)氫氧化物��,在酸性介質(zhì)中與KI作用�,定量析出I2����,用標(biāo)準(zhǔn)Na2S2O3溶液滴定�,由下式計(jì)算Co的含量���。
Co(OH)3+3H++I(xiàn)-=Co2++1/2I2+3H2O
I2+2S2O32-=2I-+S4O62-
實(shí)驗(yàn)試劑與器材
1.試劑:
臺(tái)秤 分析天平(0.1mg) 烘箱 恒溫水浴 抽濾裝置一套 漏斗和漏斗架
溫度計(jì) 酸式滴定管 堿式滴定管
2.藥品
酸:HCl標(biāo)準(zhǔn)溶液(0.5 mol·L-1) HCl(6 mol·L-1�����,濃) HNO3(6 mol·L-1)
堿:NaOH標(biāo)準(zhǔn)溶液(0.5 mol·L-1) NaOH(10%) NH3.H2O(濃)
鹽:Na2S2O3標(biāo)準(zhǔn)溶液(0.1 mol·L-1) AgNO3標(biāo)準(zhǔn)溶液(0.1 mol·L-1) K2CrO4(5%)
固體:CoCl2.6H2O NH4Cl KI 活性炭
3.其它:
H2O2(6%) C2H5OH(無(wú)水)淀粉溶液(1%)冰塊
定量濾紙(中速) pH試紙
實(shí)驗(yàn)步驟1.三氯化六氨合鈷(Ⅲ)的制備
在100mL錐形瓶中加入6g CoCl2.6H2O(s)水����,4g NH4Cl和7mL水溫?zé)崛芙夂蠹尤?.1~0.2g活性炭��。冷卻�����,往體系加入14mL濃NH3.H2O�,在低于283K的溫度下���,緩緩加入14mLH2O2(6%)之后���,將反應(yīng)容器置于60℃左右的水浴上,恒溫�,攪拌20分鐘�。用冷水冷卻��,抽濾����。將沉淀轉(zhuǎn)移到含有2mL濃鹽酸的50mL沸水中,溶解完全后����,趁熱過(guò)濾。棄去固體(活性炭)����,往濾液中慢慢加入7mL濃鹽酸,冷水冷卻���。抽濾���,用少量乙醇洗滌晶體。于105℃下烘干后稱(chēng)量�����,計(jì)算產(chǎn)率����。
2.產(chǎn)物組成的測(cè)定
(1)氨含量測(cè)定在分析天平上準(zhǔn)確稱(chēng)取0.2~0.3g三氯化六氨合鈷(Ⅲ)樣品���,置于250mL錐形瓶中,加入80~100mL的水溶解��。在另一錐形瓶中用移液管準(zhǔn)確加入40.00mL標(biāo)準(zhǔn)HCl溶液(0.5mol.L-1)����,將三角瓶置于冰水浴中,系統(tǒng)裝置如圖23—1所示��。安全漏斗下端固定于一盛有4mL左右NaOH (10%)溶液的小試管內(nèi)�,使漏斗柄浸入試管液面下2~3mm�,整個(gè)過(guò)程中漏斗柄的出口不能暴露在液面上。試管口的塞子要多鉆出一個(gè)連通孔�����,以便試管內(nèi)與錐形瓶連通�����。往樣品溶液中加入10mL NaOH(10%)溶液����,塞緊錐形瓶口�����。以盛有標(biāo)準(zhǔn)HCl溶液的錐形瓶為接受器����,將氨導(dǎo)管插入該接受器其液面下20~30mm���。確認(rèn)裝置密封性合乎要求后���,加熱樣品溶液,初用大火���,至沸后改為小火�,保持微沸狀態(tài)約1小時(shí)�。蒸出全部氨以后,拔掉氨導(dǎo)管��,停止加熱�,用少量水將導(dǎo)管內(nèi)外可能黏附的溶液洗入錐形瓶?jī)?nèi),以甲基紅為指示劑���,用0.5 mol·L-1NaOH標(biāo)準(zhǔn)溶液滴定剩余鹽酸�,從而求出樣品中氨的含量。
(2)氯含量測(cè)定將本實(shí)驗(yàn)2(1)總蒸出氨的樣品溶液中以中速定量濾紙過(guò)濾�,并用水洗滌濾紙條及沉淀數(shù)次,沉淀供本實(shí)驗(yàn)2(3)鈷含量測(cè)定之用���。濾液承接于250mL錐形瓶中并以HNO3(6 mol·L-1)酸化至pH5~6, K2CrO4(5%)為指示劑�,用標(biāo)準(zhǔn)AgNO3(0.1 mol·L-1)溶液滴定其中Cl-含量���,從而計(jì)算出樣品中的氯含量����。
(3)鈷含量的測(cè)定將本實(shí)驗(yàn)2(2)中得到的三價(jià)氫氧化物沉淀連同濾紙一并轉(zhuǎn)移到250mL碘量瓶中����,加50mL水�,用玻璃棒將濾紙盡可能的攪碎,加入1g固體KI����,搖蕩使其溶解,再加入12mL HCl(6 mol·L-1)酸化�����,置暗處約10分鐘。反應(yīng)如下:
2Co(OH)3+6H++2I-=2Co2++I(xiàn)2+6H2O
用0.1 mol·L-1標(biāo)準(zhǔn)Na2S2O3滴定析出的的I2���,至滴定溶液為淺黃色時(shí)�����,加2mL淀粉(1%)指示劑繼續(xù)滴定至藍(lán)色剛好消失為止��。依據(jù)消耗的標(biāo)準(zhǔn)硫代硫酸鈉的體積和濃度�����,即可計(jì)算出樣品中鈷的含量��。為清除濾紙影響�����,可同時(shí)作空白實(shí)驗(yàn)����。
根據(jù)上述分析結(jié)果,求出產(chǎn)品的實(shí)驗(yàn)式�����。
*廢液和固體廢棄物倒入指定容器中���。
數(shù)據(jù)處理
實(shí)驗(yàn)思考
(1)在制備過(guò)程中水浴加熱20分鐘的目的是什么����?能否加熱至沸�����?
(2)制備過(guò)程需要用7mL濃鹽酸��,為什么��?
(3)在用NaOH滴定過(guò)量HCl時(shí)���,為何不用酚酞作指示劑��,而用甲基紅?
(4)測(cè)定Cl-余量時(shí)����,HNO3酸化試液酸度為何不能過(guò)大����?
(5)要使本實(shí)驗(yàn)制備的產(chǎn)品產(chǎn)率高�����,那些步驟是比較關(guān)鍵的����?為什么?
實(shí)驗(yàn)十二 硫酸四銨合銅(Ⅱ)的制備���,組成分析及物性測(cè)定(綜合實(shí)驗(yàn))
實(shí)驗(yàn)?zāi)康?/B>
通過(guò)硫酸四銨合銅的制備����,分析到確定組成的全過(guò)程�����,掌握某些物性測(cè)試和結(jié)構(gòu)測(cè)試的方法�。
實(shí)驗(yàn)原理
配合物中銅離子的含量可通過(guò)比色分析測(cè)定。在配合物溶液中加入強(qiáng)堿�,并加熱使配合物破壞,氨就能會(huì)發(fā)出來(lái),用標(biāo)準(zhǔn)酸吸收���,再用標(biāo)準(zhǔn)堿滴定剩余的酸��,即可測(cè)得氨含量�����。硫酸根含量的確定用重量法���。這樣,就能確定配合物的化學(xué)式��。
通過(guò)X射線粉末衍射法�����。這樣��,就能確定配合物的晶體結(jié)構(gòu)����。
配合物中心離子銅的d電子組態(tài)及配合物的磁性可由磁化率測(cè)定確定。
在過(guò)渡金屬配合物中��,由于受配體的影響,中心離子的d軌道會(huì)分裂成能量不同的兩組或兩組以上的軌道�����,其能量最高和最低的d軌道之間的能量差稱(chēng)為分裂能���,用△表示??赏ㄟ^(guò)測(cè)定配合物的電子光譜,由一定的吸收峰所對(duì)應(yīng)的波長(zhǎng)來(lái)計(jì)算.��。當(dāng)d電子數(shù)目不同���,配合物的構(gòu)型不同時(shí)�,計(jì)算△值的方法也不同���。d1�����,d4�����,d6�����,d9電子�,構(gòu)型為八面體和四面體,其電子光譜只有一個(gè)簡(jiǎn)單的吸收峰����,可直接由吸收峰位置的波長(zhǎng)來(lái)計(jì)算△值。
實(shí)驗(yàn)步驟
一���、 硫酸四銨合銅的制備
取10gCuSO4.5H2O溶于14mL水中����,加入20mL濃氨水,沿?zé)诼渭?5mL95%的乙醇��,然后蓋上表面皿�����。靜置析出晶體后��,減壓過(guò)濾���,晶體用1:2的乙醇與濃氨水的混合液洗滌�����,再用乙醇與乙醚的混合液淋洗�����,然后將其在60℃左右烘干�����,稱(chēng)重�,保存待用�。
二、硫酸四銨合銅的組成測(cè)定
1. NH3的測(cè)定

圖錯(cuò)誤�����!未定義書(shū)簽�����。 測(cè)定氨的裝置
稱(chēng)取0.25-0.30g(稱(chēng)準(zhǔn)至0.0002g)樣品�����,放入250mL錐形瓶中,加80mL水溶解����,再加入10 mL10%的NaOH溶液。在另一錐形瓶中�,準(zhǔn)確加入30-35mL標(biāo)準(zhǔn)HCl溶液(0.5mol?L-1),放入冰浴中冷卻�����。
按圖1裝配好儀器�,從漏斗中加入3-5 mL10% NaOH溶液于小試管中,漏斗下端插入液面下2-3cm��。加熱樣品��,先用大火加熱����,當(dāng)溶液接近沸騰時(shí)改用小火,保持微沸狀態(tài)�,蒸餾1h左右。即可將氨全部蒸出�����。蒸餾完畢后,取出插入HCl溶液中的導(dǎo)管�,用蒸餾水沖洗導(dǎo)管內(nèi)外,洗滌液收集在氨吸收瓶中����,從冰浴中取出吸收瓶,加2滴0.1%的甲基紅溶液����,用標(biāo)準(zhǔn)NaOH溶液(0.5mol?L-1)滴定剩余的溶液��。此過(guò)程中反應(yīng)式如下:
Cu(NH3)4SO4+NaOH=CuO↓+4NH3↑+Na2SO4+H2O
按下式計(jì)算NH3含量
NH3%=
式中:c1v1:標(biāo)準(zhǔn)HCl溶液的濃度和體積; C2V2:標(biāo)準(zhǔn)NaOH 溶液的濃度和體積
G:樣品質(zhì)量: 17.04:NH3的摩爾質(zhì)量
2. SO42-的測(cè)定
用重量法分析SO42-含量����。
3. Cu2+的測(cè)定
(1)繪制工作曲線
取標(biāo)準(zhǔn)CuSO4溶液(0.2mol?L-1)配制100mL濃度分別為0.0100,0.00800�,0.00500,0.00200mol?L-1的CuSO4溶液��。
取上面配制的四種濃度的CuSO4溶液各10.00 mL��,分別加入10.00 mL氨水溶液(2 mol?L-1),混合后用2 cm比色皿在波長(zhǎng)λ為610 nm的條件下���,用72型分光光度計(jì)測(cè)定溶液吸收度�����,以吸收度A~Cu2+濃度作圖���。
(2)Cu2+的含量測(cè)定
稱(chēng)取0.34~0.37g(標(biāo)準(zhǔn)至0.0002g)樣品�,用5mL水溶解后���,滴加H2SO4(6mol·L-1)至溶液從深藍(lán)色變至藍(lán)色(表示配合物已解離)�,定量轉(zhuǎn)移到250mL容量瓶中���,稀釋至刻度�����,搖勻��。取出10.00mL����,加入10.00mL氨水(1mol?L-1),混合均勻后��,在與測(cè)定工作曲線相同的條件下測(cè)定吸光度�。
根據(jù)測(cè)定得的吸光度,從工作曲線上找出相應(yīng)的Cu2+濃度�����,并按下式計(jì)算Cu2+含量:
Cu2+%=
式中: c:工作曲線上查出的Cu2+濃度�; G:樣品質(zhì)量;
63.54:Cu摩爾質(zhì)量�。
三、硫酸四氨合銅的物性測(cè)定
1. X射線粉末衍射法確定[Cu(NH3)4]SO4·H2O的晶體結(jié)構(gòu)
用X射線衍射儀在以下條件時(shí)測(cè)定樣品�����。
管流:15mA(Cu靶)����;拋描速度:4°·min-1�����;掃描范圍:2θ從90°~10°�����;量程(CPS):10k;時(shí)間常數(shù):0.1×20�����;記錄走速:20mm·min-1����。
2.磁化率的測(cè)定
用古埃磁天平在3/4∏×106A·m-1(在數(shù)值上等于3000G)的條件下測(cè)定樣品的磁化率。
3.吸收曲線的測(cè)定
將樣品配成濃度為0.01mol·L-1的溶液���,以蒸餾水作參考���,在721型分光光度計(jì)的整個(gè)波長(zhǎng)范圍內(nèi),每隔10nm測(cè)一次吸光度��。
結(jié)果及討論
一. 實(shí)驗(yàn)結(jié)果
1. 根據(jù)組成分析的實(shí)驗(yàn)結(jié)果��,確定所測(cè)樣品中Cu2+����,NH3,SO42-和H2O的百分含量�����,并定出樣品的實(shí)驗(yàn)式。
2. 根據(jù)X衍射圖確定該配合物的晶形�����。
3. 根據(jù)測(cè)得的磁化率計(jì)算磁矩��,并確定Cu2+的外層電子結(jié)構(gòu)���。
4. 根據(jù)測(cè)得的吸光度�,作吸光度~波長(zhǎng)曲線����。在圖上找出最大吸收處的波長(zhǎng),可用下式計(jì)算[Cu(NH3)4]2+的分裂能�����。
△ =1/λ×107(cm-1)
式中:λ為最大吸收的波長(zhǎng)(nm)���。
5. 理論值和文獻(xiàn)值
(1)組分含量
理論值:Cu2+% 25.85,NH3% 27.73�����,SO42-% 39.08,H2O% 7.33����。
(2)晶形
文獻(xiàn)值:正交晶系。
(3)磁矩值
文獻(xiàn)值:1.72~2.20(μB)
(4)分裂能
文獻(xiàn)值:15100(cm-1)
二. 討論
1.各組分的含量測(cè)定還可用其它方法:
(1)用硫酸滴定銅氨配合物測(cè)得NH3含量�����。反應(yīng)式為:
Cu(NH3)42++(n-2)H++ 2 H2O =Cu(OH)2+ nNH4+
Cu(OH)2+ 2 H+= Cu2++2 H2O
在實(shí)驗(yàn)中��,通過(guò)pH滴定測(cè)得滴定曲線����,可得到以上二步反應(yīng)完全時(shí)所用的酸的體積,從而計(jì)算NH3的個(gè)數(shù)或NH3的含量���。
(2)將銅氨配合物溶于過(guò)量的鹽酸中���,再用氫氧化鈉滴定此溶液。通過(guò)pH滴定也能測(cè)得NH3的含量����。
(3)用氨氣敏電極����,直接電位法測(cè)定NH3含量���。
(4)用配合滴定��,以鉻黑T作指示劑�����,用EDTA滴定��,測(cè)得Cu2+含量���。
(5)用磺量法測(cè)Cu2+含量,在酸性溶液中(pH=3~4)�����,Cu(NH3)42+被破壞��,Cu2+與I—作用�����,產(chǎn)生I2�����,再用Na2S2O3溶液滴定I2�����,即可得Cu2+含量�。
2.一般說(shuō)來(lái),根據(jù)磁性能判斷配合物中心原子的氧化態(tài)及電子構(gòu)型和立體結(jié)構(gòu)有一定困難�。因Cu2+有三種可能的成鍵構(gòu)型,二種不同的立體結(jié)構(gòu)��。這三種成鍵構(gòu)型是:
(1) 離子性四面體
(2) 共價(jià)性四面正方形dsp2
(3) 共價(jià)性四面體sp3
其中每種都含有一個(gè)未成對(duì)的電子因而無(wú)法區(qū)別�����,需用其它方法來(lái)確定�����。
3.討論配位數(shù)���。在一些書(shū)中銅配合物表示成[Cu(H2O)6]2+��,[Cu(NH3)6]2+等��,它的配位數(shù)是6�,但在另一些書(shū)上則寫(xiě)成[Cu(NH3)4]2+,配合物是4�。為什么會(huì)有二種不同的寫(xiě)法呢?較為確切的解釋是:當(dāng)Cu2+溶解在過(guò)量的水中時(shí)���,形成藍(lán)色的水合離子[Cu(H2O)6]2+�。在[Cu(H2O)6]2+中加入氨水時(shí)�����,形成深藍(lán)色的[Cu(NH3)4(H2O)2]2+����,第5,6二個(gè)水分子的取代較困難�,只有在液氨中才能制得[Cu(H2O)6]2+。在固體水合鹽中一般配位數(shù)為4�。
4.討論立體結(jié)構(gòu)。Cu2+的配位離子是變形八面體或平面四方形結(jié)構(gòu)�����,在[Cu(NH3)4(H2O)2]2+中,四個(gè)NH3以短鍵和Cu2+結(jié)合����,經(jīng)常用[Cu(NH3)4(H2O)2]2+來(lái)表示�����,所以這個(gè)配離子也可以用四方形結(jié)構(gòu)描述���。用價(jià)鍵理論無(wú)法說(shuō)明Cu2+的配合物為平面四邊形結(jié)構(gòu)����,因?yàn)樾纬蒬sp2構(gòu)形必需激發(fā)一個(gè)電子從3d進(jìn)入4p軌道�����,即統(tǒng)計(jì)��,在其態(tài)時(shí)這樣的激發(fā)需能量1422.56KJ,且電子位于高能的4p軌道容易失去�,這恰與實(shí)驗(yàn)事實(shí)相反,因?yàn)镃u2+的配合物非常穩(wěn)定���,難于氧化成Cu3+的配合物���。
思考題
1��、 重量法測(cè)定SO42-含量時(shí)���,為了得到較大結(jié)晶顆粒的BaSO4,沉淀?xiàng)l件是什么����?
2、 在轉(zhuǎn)移��,洗滌���,灼燒BaSO4時(shí)��,應(yīng)注意些什么��?
3�����、 不同勵(lì)磁電流下測(cè)得的樣品摩爾磁化率是否相同�����?
參考文獻(xiàn)
[1] 羅勤慧��,沈孟長(zhǎng)編著�,配位化學(xué),江蘇科技出版社�,1978年
[2] 北京師范大學(xué)等校編��,無(wú)機(jī)化學(xué)��,高等教育出版社���,1988年
[3] 方惠群�����,虞振新等編�,電化學(xué)分析��,原子能出版社����,1984年
[4] 吉林大學(xué)等校編,物理化學(xué)基本原理,人民教育出版社�,1977年
實(shí)驗(yàn)十三 由碳酸氫銨和食鹽制備碳酸鈉(綜合實(shí)驗(yàn))
實(shí)驗(yàn)?zāi)康?/B>
1、 通過(guò)實(shí)驗(yàn)了解聯(lián)合制堿法的反應(yīng)原理�����,學(xué)會(huì)利用各種鹽類(lèi)溶解度的差異�,并通過(guò)復(fù)分解反應(yīng)制取鹽的方法。
2��、 初步掌握測(cè)定碳酸鈉中碳酸氫鈉含量的定量分析方法�。
預(yù)習(xí)要點(diǎn)
一、預(yù)習(xí)氨堿法和聯(lián)合制堿法制備純堿的原理以及酸堿中和原理�����。
二�、思考并回答下列問(wèn)題
1、為什么要預(yù)先去食鹽中含鈣����、鎂離子?而不預(yù)先除去硫酸根離子��?
2���、為什么計(jì)算Na2CO3產(chǎn)率時(shí)要根據(jù)NaCl的用量�����?影響Na2CO3產(chǎn)率的因素有哪些�����?
3���、 �、
�、 �、
�、 和
和 四種鹽不同溫度下在水中的溶解度(g/100gH2O)如表所示��。
四種鹽不同溫度下在水中的溶解度(g/100gH2O)如表所示��。
表  ��、
��、 ��、
��、 和
和 溶解度對(duì)照表
溶解度對(duì)照表
溫度
(℃)
溶解度
鹽
| 0
| 10
| 20
| 30
| 40
| 50
| 60
| 70
| 80
| 90
| 100
|
NaCl
NH4HCO3
NaHCO3
NH4Cl
| 35.7
11.9
6.9
29.4
| 35.8
15.8
8.15
33.3
| 36.0
21.0
9.6
37.2
| 36.3
27.0
11.1
41.4
| 36.6
-
12.7
45.8
| 37.0
-
14.45
50.4
| 37.3
-
16.4
55.2
| 37.8
-
-
60.2
| 38.4
-
-
65.6
| 39.0
-
-
71.3
| 39.8
-
-
77.3
|
根據(jù)表����。所列四種鹽的溶解度,解釋為什么轉(zhuǎn)化操作時(shí)溶液的溫度最好控制在30—35℃之間��。
基本原理
碳酸鈉在工業(yè)上叫純堿,是重要的化工原料���。目前工業(yè)上制純堿主要采用氨堿法和我國(guó)化學(xué)家侯德榜(1890—1974)提出的聯(lián)合制堿法����。聯(lián)合制堿法是將CO2和NH3通入NaCl溶液中先制成NaHCO3�����,再在高溫下灼燒生成Na2CO3�����,副產(chǎn)物是NH4Cl�。主要化學(xué)反應(yīng)可表示如下:


以上第一個(gè)反應(yīng),可以看成是碳酸氫銨和氯化鈉在水溶液中的復(fù)分解反應(yīng)����。

 、
、 ����、
����、 和
和 同時(shí)存在于水溶液中,是一個(gè)復(fù)雜的四元交互體系��,它們?cè)谒芤褐械娜芙舛然ハ喟l(fā)生影響。但是��,可以根據(jù)各種純凈鹽在不同溫度下在水中溶解度的不同�����,選擇分離幾種鹽的最佳條件和適宜的操作步驟��。
同時(shí)存在于水溶液中,是一個(gè)復(fù)雜的四元交互體系��,它們?cè)谒芤褐械娜芙舛然ハ喟l(fā)生影響。但是��,可以根據(jù)各種純凈鹽在不同溫度下在水中溶解度的不同�����,選擇分離幾種鹽的最佳條件和適宜的操作步驟��。
儀器和藥品
布氏漏斗���、吸濾瓶����、馬福爐�����、蒸發(fā)皿��、分析天平�、稱(chēng)量瓶�����、酸式滴定管(50ml)、量筒(100mL)��、燒杯(150mL)��、粗食鹽�、NaOH(3mol·L-1)Na2CO3(3mol·L-1)、HCl(6 mol·L-1)�、標(biāo)準(zhǔn)HCl溶液(0.1 mol·L-1)、NH4HCO3(固)���、酚酞溶液�����、甲基橙溶液�����、溫度計(jì)(0—100℃)��、錐形瓶(250mL)
實(shí)驗(yàn)內(nèi)容
一��、碳酸鈉的制取
1����、化鹽和精制 在150mL燒杯中注入50mL 24—25%的粗鹽水溶液。用3mol·L-1NaOH和3mol·L-1Na2CO3溶液的混合溶液(體積為1:1)調(diào)整PH值至11左右�,得到膠狀 沉淀,以除去食鹽中所含的鈣����、鎂雜質(zhì)。
沉淀,以除去食鹽中所含的鈣����、鎂雜質(zhì)。


注入混合堿液后���,加熱至沸�,抽濾����,分離沉淀。將濾液用6 mol·L-1HCl調(diào)整pH值至7��。解釋為什么要用HCl調(diào)整PH值����?
2、轉(zhuǎn)化 將盛有濾液的燒杯放在水浴上加熱��,控制溶液溫度在30—35度之間�。在不斷攪拌的情況下�����,分多次把21g研細(xì)的 加入濾液中,加完后繼續(xù)保溫?cái)嚢璋胄r(shí)�,然后靜置,抽濾����,得到
加入濾液中,加完后繼續(xù)保溫?cái)嚢璋胄r(shí)�,然后靜置,抽濾����,得到 晶體,用少量水洗滌2次�,以除去附著在表面的銨鹽。再將晶體進(jìn)行抽濾干燥��,稱(chēng)此產(chǎn)物質(zhì)量���。所得母液回收����,留作制取氯化銨之用�����。
晶體,用少量水洗滌2次�,以除去附著在表面的銨鹽。再將晶體進(jìn)行抽濾干燥��,稱(chēng)此產(chǎn)物質(zhì)量���。所得母液回收����,留作制取氯化銨之用�����。
3�、制純堿 將抽干的 放入蒸發(fā)皿中,在馬福爐中,于300℃下灼燒2小時(shí)��,即發(fā)生分解反應(yīng)得到純堿��。等冷卻到室溫時(shí)����,稱(chēng)量制得的純堿的質(zhì)量。
放入蒸發(fā)皿中,在馬福爐中,于300℃下灼燒2小時(shí)��,即發(fā)生分解反應(yīng)得到純堿��。等冷卻到室溫時(shí)����,稱(chēng)量制得的純堿的質(zhì)量。
二��、產(chǎn)品檢驗(yàn)
用分析天平準(zhǔn)確稱(chēng)?��。?zhǔn)確0.001g)制得碳酸鈉晶體二份��,每份為m克(約0.25g左右)��。將其中一份放入錐形瓶中用100ml蒸餾水溶解��,滴入2滴酚酞指示劑���,使溶液變紅色。用已知準(zhǔn)確濃度為CHCl的鹽酸溶液滴定至溶液的紅色剛剛退去�����,記下所用鹽酸體積V1����,再滴入2滴甲基橙指示劑,此時(shí)溶液應(yīng)顯黃色����。繼續(xù)用上述鹽酸溶液滴定,使溶液由黃色至橙色���,加熱煮沸1—2分鐘���,冷卻后溶液又呈黃色,再用鹽酸滴定至橙色����,半分鐘不退為止。記下所用鹽酸總體積V2��。樣品中Na2CO3和 的百分含量可分別按下式計(jì)算:
的百分含量可分別按下式計(jì)算:


式中: CHCl——標(biāo)準(zhǔn)HCl溶液的濃度���;
V1——第一個(gè)滴定終點(diǎn)用去標(biāo)準(zhǔn)HCl溶液的體積����;
V2——第二個(gè)滴定終點(diǎn)用去標(biāo)準(zhǔn)HCl溶液的體積;
 ——Na2CO3的摩爾質(zhì)量���;
——Na2CO3的摩爾質(zhì)量���;
m——樣品質(zhì)量�����;
 ——
—— 的摩爾質(zhì)量����;
的摩爾質(zhì)量����;
純堿的產(chǎn)率計(jì)算
理論產(chǎn)量:由粗鹽(按90%)計(jì)算�����。
實(shí)際產(chǎn)量:由產(chǎn)品質(zhì)量 Na2CO3的百分含量����。
Na2CO3的百分含量����。

另一份樣品按上述實(shí)驗(yàn)步驟和計(jì)算方法重復(fù)一遍,將數(shù)據(jù)和結(jié)果匯總于表錯(cuò)誤�����!未定義書(shū)簽�。中。
表�。 純堿的分析數(shù)據(jù)和Na2CO3產(chǎn)率
實(shí)驗(yàn)次數(shù)
| 樣品重量
m/g
| HCl體積/dm3
| HCl濃度
(mol·L-1)
| Na2CO3
%含量
| NaHCO3
%含量
| Na2CO3
產(chǎn)率
|
V1
| V2
|
1
2
|
|
|
|
|
|
|
|
附 錄
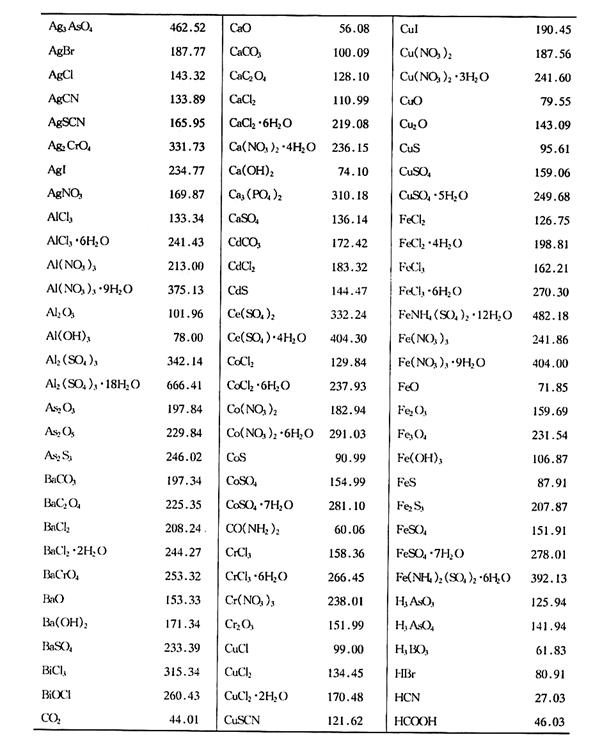
附錄1 相對(duì)原子質(zhì)量表
(國(guó)際純粹與應(yīng)用化學(xué)聯(lián)合會(huì)1993年公布)
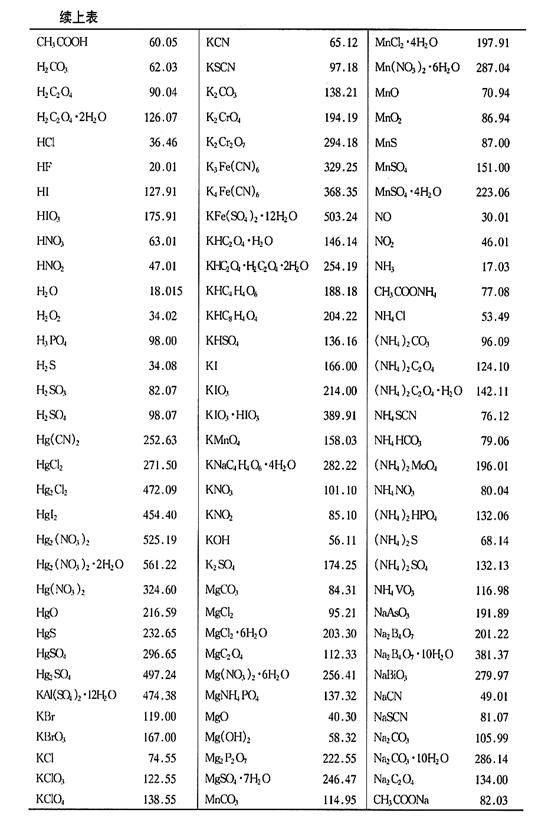
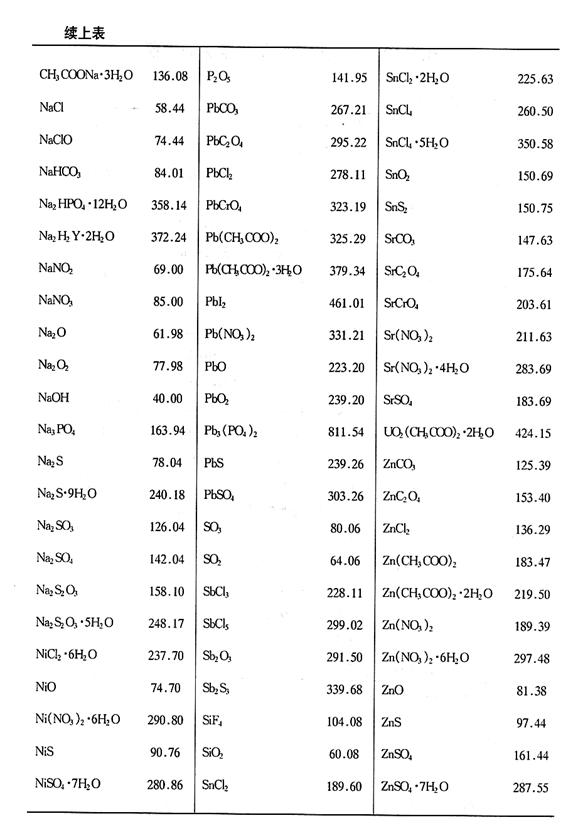
附錄2 常用化合物的相對(duì)分子質(zhì)量表
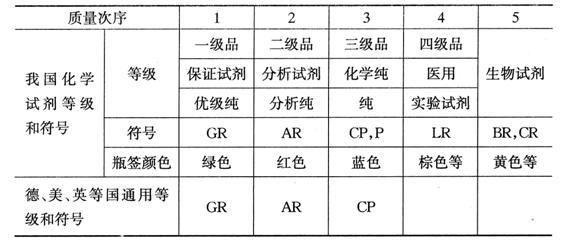
附錄3 化學(xué)試劑等級(jí)對(duì)照表
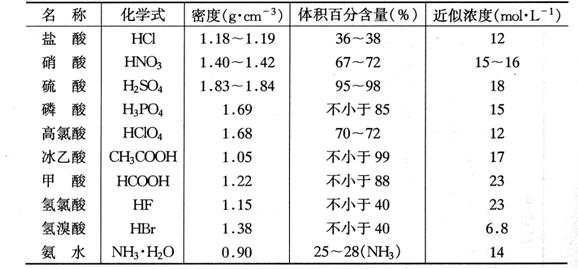
附錄4 常用酸堿試劑的密度���、含量和近似濃度
附錄5 常用指示劑
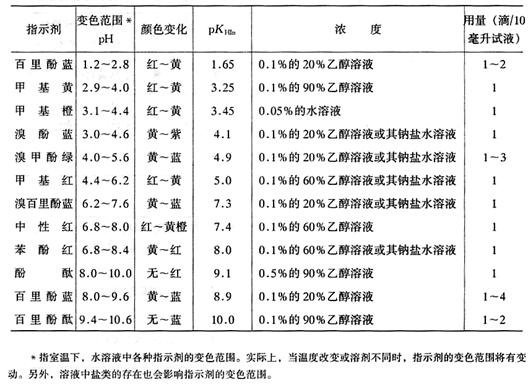
1.酸堿指示劑
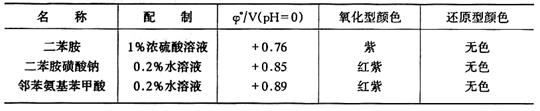
2.氧化還原指示劑
3.絡(luò)合指示劑
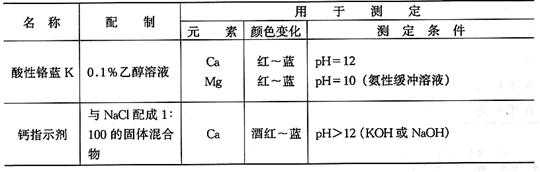
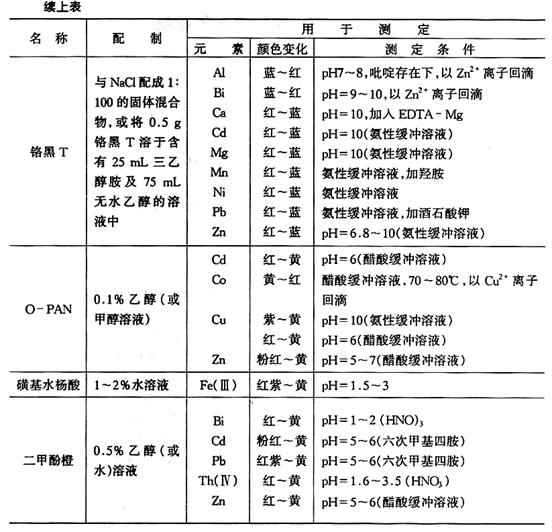
參考文獻(xiàn)
1. 武漢大學(xué).分析化學(xué)實(shí)驗(yàn),高等教育出版社(第四版)����,2001年5月.
2. 陳華序����,鄭沛霖等.分析化學(xué)簡(jiǎn)明教程,冶金工業(yè)出版社�,1989年6月.
3. 李發(fā)美等.分析化學(xué)實(shí)驗(yàn)指導(dǎo),人民工業(yè)出版社�����,2004年2月.
4. 四川大學(xué)��,浙江大學(xué).分析化學(xué)實(shí)驗(yàn)���,高等教育出版社(第三版)��,2003年6月.
5. 鄧玲靈.現(xiàn)代分析化學(xué)實(shí)驗(yàn)��,中南大學(xué)出版社����,2002年8月.