《師范專業(yè)實驗》課程
|
|
|
課程編號:407305
|
|
|
實驗指導書
|
|
|
|
|
|
|
|
| 主撰人:
| 陳 艷
|
| 審核人:
| 顏智殊
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
化學與材料科學系
|
基礎化學教研室
|
二○一二年六月
|
|
|
目 錄
|
| 前 言
| 1
|
實驗1
| 走進中學化學實驗室
| 2
|
實驗2
| 噴燈的使用和玻璃的加工
|
|
實驗3
| 氣體的制備與性質(zhì)研究—氫氣
|
|
實驗4
| 電解水實驗研究
|
|
實驗5
| KNO3在水中溶解度的測定及溶解度測定曲線的繪制
|
|
實驗6
| 物質(zhì)的提純——粗鹽的提純
|
|
實驗7
| 紙上層析
|
|
實驗8
| “阿佛加德羅常數(shù)的測定(單分子膜法)”
|
|
實驗9
| 堿金屬及其化合物的性質(zhì)實驗
|
|
實驗10
| 豆腐中鈣質(zhì)和蛋白質(zhì)檢驗
|
|
實驗11
| 香煙煙霧中幾種毒物的測定
|
|
實驗12
| 甲烷的制法與性質(zhì)
|
|
實驗13
| 氨的合成
|
|
實驗14
| 物質(zhì)的性質(zhì)與反應研究——木炭還原氧化銅
|
|
實驗15
| 氨催化氧化制硝酸
|
|
實驗16
| 趣味化學實驗研究——金屬鏡
|
|
實驗17
| 碘量法測定溶解氧
|
|
實驗18
| 氯化氫的制備——氫氯爆鳴
|
|
|
|
|
|
前 言
實驗總體目標:
| 對中學化學實驗進行實驗研究與探索���。
|
適用專業(yè)年級:
| 化學專業(yè)師范方向三年級第二學期
|
實驗課時分配:
| 36學時
|
序號
| 實驗項目
| 要求
| 類型
| 每組人數(shù)
| 實驗
學時
|
1
| 走進中學化學實驗室
| 必做
| 講解
| 2
| 4
|
2
| 噴燈的使用和玻璃的加工
| 必做
| 基本操作
| 2
| 4
|
3
| 氣體的制備與性質(zhì)研究—氫氣
| 必做
| 探究
| 2
| 4
|
4
| 電解水實驗研究
| 必做
| 研究
| 2
| 4
|
5
| KNO3在水中溶解度的測定及溶解度測定曲線的繪制
| 必做
| 設計
| 2
| 4
|
6
| 物質(zhì)的提純——粗鹽的提純
| 必做
| 綜合
| 2
| 4
|
7
| 紙上層析
| 必做
| 綜合
|
| 4
|
8
| “阿佛加德羅常數(shù)的測定(單分子膜法)”
| 必做
| 探究
|
| 4
|
9
| 堿金屬及其化合物的性質(zhì)實驗
| 必做
| 演示
|
| 4
|
10
| 豆腐中鈣質(zhì)和蛋白質(zhì)檢驗
| 必做
| 設計
|
| 4
|
11
| 香煙煙霧中幾種毒物的測定
| 選做
| 設計
|
| 4
|
12
| 甲烷的制法與性質(zhì)
| 必做
| 綜合
|
| 4
|
13
| 氨的合成
| 選做
| 綜合
|
| 4
|
14
| 物質(zhì)的性質(zhì)與反應研究——木炭還原氧化銅
| 選做
| 探究
|
| 4
|
15
| 氨催化氧化制硝酸
| 選做
| 綜合
|
| 4
|
16
| 趣味化學實驗研究——金屬鏡
| 選做
| 探究
|
| 4
|
17
| 碘量法測定溶解氧
| 選做
| 綜合
|
| 4
|
18
| 氯化氫的制備——氫氯爆鳴
| 選做
| 設計
|
| 4
|
19
| 自主設計實驗——考核(占成績40%)
| 選做
| 設計
|
| 4
|
|
|
|
|
|
|
|
實驗環(huán)境
要求每次可提供至少10套可正常使用的實驗裝置����,實驗室面積為60平方米以上��,室內(nèi)采光通風良好衛(wèi)生�����,供電正常��,消防設備齊全���,疏散通道正常��。
實驗總體要求
通過本實驗課程的教學�,學生能:
1����、明確化學實驗在中學化學教學中的地位和功能。
2�、了解化學教學論對化學實驗教學的要求,打牢化學實驗教學的理論基礎��。
3��、理解中學各類化學實驗的教學要求����,掌握中學各類化學實驗的教學方法。
4����、突出“研究”化學實驗用于中學化學教學的最佳條件組合及最佳教學途徑。
5、初步學會運用現(xiàn)代教育技術進行化學實驗教學���。
本課程的重點�、難點及教學方法建議
1�����、重點:中學各類課堂演示實驗的教學方法和教學要求�。
2、難點:實踐探究中學各類課堂演示實驗的最佳實驗條件組合��。
3����、教學方法建議:學生在老師下的指導及多參閱其他文獻,對中學化學實驗自主進行探究�����。
實驗一 走進中學化學實驗教學
現(xiàn)代的化學研究雖然動用了大量的先進儀器進行物理測試����,也采用了高新計算方法和技術進行理論預測,但總離不開傳統(tǒng)的化學實驗方法�����。作為中學化學教學內(nèi)容的重要組成部分——化學實驗來說�,它更是一種最生動、最直觀的教學手段��。因此���,師范教學一定要把實驗技術等的研究放在相當重要的位置��,并從師范生的要求和特點上提高認識�����,在具體的實驗教學課程中有步驟地進行改革�、探索��。
一��、化學實驗在中學化學教學中的意義和作用
不論是從人類認識規(guī)律�����,還是從發(fā)展學生的智力與能力����、培養(yǎng)他們科學的世界觀和方法論�、提高他們的綜合素質(zhì)等角度來看����,化學實驗都具有十分重要的作用。
一個概念的形成���,常常需要一個過程���。從實踐出發(fā),首先獲得一種感性認識�,然后經(jīng)過分析、概括����、推理,慢慢形成了一個概念��,并在以后的發(fā)展中不斷得到發(fā)展����、完善。因此一個概念一般都是比較抽象的��,化學概念也是這樣。如果我們的教師能夠適當配合演示實驗���,而且具有較理想的實驗效果��,無疑會激發(fā)學生的學習興趣,幫助學生形成概念��。同樣�����,通過實驗可以使學生更好地理解和深入地領會化學定律和化學原理�����,在幫助學生進一步消化和鞏固所學的化學知識方面起到積極的作用����。
實驗也是發(fā)展學生智力、培養(yǎng)辯證思維能力的一項重要措施����。學生從觀察到的實驗現(xiàn)象中可以自已來解釋、歸納�����、推理一些規(guī)律,通過自已積極的思維活動�,自已給出結論。因此教師不管在演示實驗還是在組織學生實驗��,或是在開展課外興趣活動中��,都要引導學生仔細觀察實驗現(xiàn)象�����,積極思考實驗中的問題��,認真總結實驗規(guī)律和結論�,以便進一步將感性認識上升到理性認識。
運用化學實驗不僅可以引導學生唯物地認識自然�,還可以培養(yǎng)他們辯證地了解自然,掌握自然發(fā)展規(guī)律���。例如氧化-還原反應這個對立統(tǒng)一規(guī)律�����,中和滴定中的量變到質(zhì)變的飛躍����,化學反應中內(nèi)部結構和外部條件的關系,化分和化合的關系……如此等等�。所有這些對于形成學生辯證唯物主義世界觀都具有十分重要的意義。
化學實驗或是化學演示�����、或是學生自已操作���,都可以使學生學會或進一步掌握一些常用儀器的實用技能和實驗操作方法,如選用化學儀器�����、取用化學試劑�,加熱、冷卻等控制化學反應條件����,分液、蒸發(fā)��、萃取�����、結晶、過濾��、洗滌��、干燥�、等物質(zhì)的分離、提純等等���,使學生變得心靈手巧���。并能進一步培養(yǎng)他們自已設計實驗方案、選用儀器裝置和藥品�����、觀察和分析實驗現(xiàn)象����、記錄和分析實驗數(shù)據(jù)、歸納和總結實驗結論等一整套實驗研究的方法���,培養(yǎng)他們嚴肅認真的科學態(tài)度和利用實驗解決一些簡單的化學實際問題的能力�����,以及有序地進行工作的習慣�。而要做到這一些,選修課�、課外興趣小組活動將可充分發(fā)揮其作用,在此是大有用武之地的����。
二、各類教學實驗的基本要求
基于上述分析�,作為我們每一位即將走上中學化學教學崗位的同學(以下稱實習教師)來說�����,進一步具體了解各類教學實驗的作用和要求是十分必要的���。否則在實習時可能會感到無所適從�����。
1���、演示實驗
演示實驗是在課堂教學時由教師進行表演示范的實驗����。教師通過演示實驗可以指導學生觀察現(xiàn)象��,引導學生思維���,幫助學生獲得正確而深刻的認識�����。演示實驗是化學實驗教學一種傳統(tǒng)而基本的教學形式��,通過演示實驗聲�、光�、色的效果給學生生動、直觀��、鮮明���、深刻的印象�,故它是目前我國中學化學中運用最為廣泛的實驗教學形式之一���。其具體要求是:必需明確演示實驗的目的和要求�,設計好實驗教學的具體方案、過程����,注意在實驗中要引導學生觀察、思考�,從中培養(yǎng)學生的創(chuàng)造精神和解決問題的能力。
a��、要保證實驗的可見度���、簡易性�、成功率和安全性�����。實驗裝置及操作在不影響實驗效果的前提下要力爭簡易��、突出主題�,要使全體學生都能有效����、清晰地觀察到實驗現(xiàn)象,每一次實驗都應力爭一次成功,萬一失敗要分析原因���,重新再做�����,切勿文過飾非�、遮遮蓋蓋���。實驗的多種安全因素中應考慮到環(huán)保的問題����。
b�、演示實驗的準備要仔細、認真��,大部分實驗應在課前作預試�����,
要充分考慮到課堂演示時可能發(fā)生的各種突發(fā)性問題����,并作好預防措施����。實驗演示時��,操作要規(guī)范�,器材的放置、藥品的取用�����、實驗的講解要有條不紊�����。
c��、演示實驗的教學有多種模式�,在執(zhí)教中應根據(jù)具體情況作出相應的選擇。另外��,演示實驗時還可以借用幻燈�����、投影儀等電化教學手段來提高和強化實驗教學的效果����。
2、學生實驗和并進實驗
在化學課堂教學實驗中�����,由學生動手操作的實驗主要有學生實驗和并進實驗兩大類�。與演示實驗相比,它更有利于學生實驗操作技能的訓練����、培養(yǎng),更能調(diào)動學生學習化學知識的積極性��,對實驗的各種現(xiàn)象更易觀察����,從而印象也更深刻。學生動手操作的實驗在化學實驗教學中占有很重要的地位���,它極有利于培養(yǎng)學生的實踐能力和創(chuàng)造能力��,所以被列為化學教學中一類獨特而重要的教學形式����。學生動手操作的實驗一般要注意以下幾點要求:
a、強調(diào)安全
與演示實驗相比�����,由學生動手操作的實驗應格外注意安全����,對易燃、易爆��、有毒���、有強腐蝕試劑等實驗����,必需改進到十分安全才能編排給學生操作�����。尤其是并進實驗(又稱隨堂實驗或邊講邊實驗)�����,由于學生活動空間小�����,又無水源���、通風等設施��,所以要用到濃酸�、堿�、高溫或會產(chǎn)生有臭、有毒氣體的實驗一般都不宜安排�����。為了安全��,在學生實驗時教師必需經(jīng)常巡視���,及時剔除一切不安全的苗子�。
b�����、實驗簡單短小�,操作方便
與演示實驗相比�,學生實驗選用的儀器應少些�����、小些�,裝置盡可能簡單些,實驗內(nèi)容也相對較單一���。對于并進實驗�����,實驗時間不宜長�����,操作更應簡易些����,如水浴����、蒸鎦較復雜的裝置及操作均不能選入。
c、準備充分周密����,教法科學得體
給學生準備的實驗必需充分考慮到每一個細小的環(huán)節(jié),有時一個小小的失誤�,就會影響到整個教學過程的進行。給每一組的儀器��、試劑都必需保質(zhì)保量���,不能有遺漏實驗物品的情況發(fā)生。學生實驗在教法上要防止產(chǎn)生讓學生盲目跟隨���、照方配藥的情況��,應該讓學生動手又動腦,知道為什么要做�、怎樣去做的原理���。通過實驗活動能切實培養(yǎng)學生的創(chuàng)造���、設計能力和實踐能力。
d��、強調(diào)實驗紀律,認真?zhèn)湔n
學生實驗必需經(jīng)常強調(diào)實驗紀律方面的教學�,如實驗室安全方面的紀律、實驗室衛(wèi)生方面的紀律��、實驗用品領用保管方面的紀律等等����。鐵的實驗紀律是使每個學生能在實驗室自由寬松的氛圍中愉快有效學習的保障。學生實驗課常會產(chǎn)生種種教師意想不到的問題��,為此教師必需充分�、認真地備好課,不打無準備之仗��。
3�����、課外活動實驗
化學課外活動的目的在于激發(fā)和發(fā)展學生對化學的興趣�,把化學課上獲得的知識加以鞏固、擴展和加深�����。這有利于學生發(fā)展智力���,拓寬知識面�,培養(yǎng)他們獨立工作能力和創(chuàng)造能力。課外活動的形式有多種多樣���,如成立化學興趣小組�,組織課外參觀����、閱讀、專題報告會��,舉辦化學晚會��、化學競賽�����、自作教具模型展覽會等等�����。就化學實驗興趣小組而言�,通常有如下的一些做法和要求:
a�����、參加人數(shù)在10人左右,以自愿參加為原則����。每周活動1~2次,小組配正���、副組長各一名(學生當)����。
b�、活動項目、內(nèi)容��、進程等應充分聽取學生意見��,必要時可共同討論����。教師起主導、輔助的作用��。
c��、小組要制定中、長期的活動規(guī)劃�����,每次活動要制定明確的目標和要求����,具體的活動方案也應由學生討論后決定,然后征求教師意見�����。
d����、實驗活動后要善于及時總結經(jīng)驗教訓�����,可以組織報告會����,或?qū)懟瘜W小論文等。模擬科學家進行學術研究的方法���。
e��、實驗活動內(nèi)容可來自化學教材��,也可來自生活��、生產(chǎn)及環(huán)保等領域�����。選題時要注意實驗的安全性��,趣味興��,可操作性���,最好還具有一定的社會效益或經(jīng)濟效益����。
三���、關于本課程改革的幾點思考
指導思想:
隨著中學化學教育的步步深入��,課程設置����、教學安排乃至選用教材都會有很大的變動。不少學校已經(jīng)提出����,作為一名骨干教師應該做到三“會”:會開一門主課;會上一門選修課;會帶一個課外興趣小組。近年上海等地區(qū)又進一步提出了把化學課程分成基礎型課程(必修)���、拓展型課程(選修)和研究(探究)型課程(選修)等三種�����。這三種類型的化學課程形態(tài)都包含有化學實驗教學�。在基礎型課程中�,實驗教學要求培養(yǎng)學生基礎學力,注意發(fā)展性學力和創(chuàng)造性學力基礎的培養(yǎng)��。在拓展型課程中�,實驗教學要求培養(yǎng)學生發(fā)展性學力���,兼顧創(chuàng)造性學力的培養(yǎng)��,并發(fā)展學生喜歡化學����、贊賞化學的個性。在研究型課程中��,實驗教學除了培養(yǎng)學生創(chuàng)造性學力外��,還要求能發(fā)展學生探究化學問題的意識�,學會探究化學問題的科學方法。顯然���,在上述這些化學課程中�����,化學實驗的教學和活動形式是多樣化的�����。我們師范教育應該適應這種形勢發(fā)展的要求�����。
1���、一年一度的教育實習不僅是我系教學計劃中一個十分重要以至不可缺少的組成部分��,也是檢驗我們教學質(zhì)量的一個重要環(huán)節(jié)�,可以說是師大開向全市的一個窗口���。因此我們必需提前進行實質(zhì)性教學訓練和預演����。
2�����、 作為本課程的改革����,應該使廣大實習教師更好發(fā)揮自己的積極主動性,真正體現(xiàn)參與性���、討論性和實踐性��,對某些實驗可作進一步的研究����、探索和開發(fā)�����。因為好多實驗在前期課程可能做過�����,現(xiàn)在再做不是簡單的重復�,而是按上面提到的教學原則和要求去體驗、去實踐�。
具體安排:
1、 基于上述想法��,我們實驗內(nèi)容的取材主要來源于三個方面:一為配合教師課堂的演示實驗;二為組織學生實驗的實驗課實驗;三為開展課外活動的獨立��、設計實驗�����。實驗的次數(shù)不多���,但要做精�、做好�、做到真正符合要求。
2、 我們的實驗課���,除了要求實習教師動手做以外�����,還要騰出時間講解�。配合課堂教學的演示實驗��,要真刀真槍邊研邊做����,組織學生實驗的也要交代實驗的目的、要求���、注意事項等等�����。為此���,除了要寫實驗報告外,還要寫教案或把兩者結合起來��。
3、 實習教師應該自己動手準備實驗�����,自行設計的實驗所需儀器���、藥品可向?qū)嶒灲處燁I取,某些材料還需自已尋找���、制作��,因此有的實驗需做二次��、三次等�����。某些開發(fā)性��、研究性實驗可以由同學選做��,然后交流��,并在交流中不斷改進�、提高。
實驗二化學實驗基本操作練習——噴燈的使用與玻璃管加工
實驗目的
1����、掌握酒精噴燈的使用方法;
2、掌握玻璃管的簡單加工和裝配實驗裝置的方法�。
一、酒精噴燈的構造與使用方法:
1����、觀察酒精噴燈的結構,檢查并加裝酒精�����,燈內(nèi)貯酒精量不能超過酒精壺的2/3�。噴燈內(nèi)酒精使用一般不超過60分鐘。若酒精快用完��,應先熄滅����,添加酒精后再繼續(xù)使用。
2����、酒精噴燈的預熱與點火:預熱盤中加少量酒精點燃��,預熱后有酒精蒸汽逸出�,便可將燈點燃����。若無蒸汽,用探針疏通酒精蒸汽出口后�����,再預熱��,點燃�。
3���、火焰的調(diào)節(jié):調(diào)節(jié)空氣進氣量�,使火焰保持適當高度����,觀察火焰形狀,此時火焰呈黃色�。逐漸加大空氣進入量,黃色火焰逐漸變藍�����。觀察各層火焰顏色。
4���、火焰的性質(zhì)試驗:
(1)將石棉網(wǎng)鐵絲往平放在無色火焰中�,從火焰上部慢慢向下移動��,注意觀察鐵絲網(wǎng)變成紅熱部分的面積和光亮程度����,用圖表示。
(2)將一根長約15cm的細玻璃彎管�����,一頭斜分別插到火焰內(nèi)中外三層����,轉動玻管點燃玻璃管的另一端出來的氣體。
根據(jù)以上實驗����,對火焰各層火焰的氧化還原性和溫度高低做出結論。
二��、截斷玻璃管和玻璃棒
1、玻管的截斷
將長玻管平放在實驗臺上�����,用左手撳住����,在要截斷的地方將三角銼刀按上(或玻璃刀、小沙輪)用力向前或向后劃一劃痕(注意只能向一個方向劃)����,如果劃痕很不明顯�,可在原處再銼1-2下。然后拿起玻管���,使玻管的劃痕朝外�����,兩手的拇指放于劃痕背后�,輕輕地用力向前推壓���,同時兩手向兩側拉動��,即可使玻管折斷�����。折斷粗玻管時����,為防止劃傷手,可用布將玻管兩端包住�����。如此重復����,使長玻管被截斷成15-20cm左右長的短玻管若干支。觀察玻管端口顏色��,確定玻管是質(zhì)玻璃還是軟質(zhì)玻璃���。
2����、玻管管口熔光
新截斷的玻璃管切口銳利,容易劃傷皮膚��,需要熔光���?���?蓪⒐芸谥糜趪姛粞趸娴倪呇靥?����,不斷地轉動�����,使玻璃管受熱均勻�,片刻后�,管口玻璃毛刺即可熔化而成平滑的管口。注意:加熱時間不可太長����,否則管口口徑縮小,燒熱的玻管�����,不可直接放在桌子上,應放在石棉網(wǎng)上�,更不可用手去摸發(fā)燙的一端,小心燙手�����。觀察玻管燃燒火焰顏色�,確定玻管是否是鈉玻璃。
三�����、彎玻管
兩手手心向上輕握玻璃管的兩端��,將要彎曲的地方移入噴燈的氧化焰中�,來回移動加熱玻璃管以增大受熱面積,緩慢均勻地轉動玻璃管�,轉動時兩手用力要均等,轉速一致����,否則玻管變軟后會扭曲變形。當玻管燒至黃紅色且足夠軟化后���,調(diào)整好身體姿態(tài)���,從火焰中取出�����,稍等片刻����,成“V”字手形����,彎曲玻管至一定角度。大角度的可一次彎成���,小角度的若不能一次彎成����,可分幾次彎�,不過受熱部位應適當向左或右調(diào)整�,轉動時可固定一只握玻管手的位置,同時注意不可使玻管在火焰中扭曲����。角度要求:彎120°��、90°�、60°三種角度玻璃管各一支�。
四、拉滴管(burette)和毛細管(capillary)
兩手手心向上輕握玻璃管的兩端�,將要加熱的部位移入噴燈的氧化焰中,來回移動加熱玻璃管以增大受熱面積���,均勻用力緩慢地轉動玻璃管����。當玻管燒至黃紅色且足夠軟化后(比彎玻管時更軟)����,快速移出火焰,稍等片刻�����,順水平軸線方向均勻用力拉玻管(拉至中間毛細管內(nèi)徑在2mm,長約8cm)�,置于石棉網(wǎng)上讓玻管自然冷卻。
冷卻后��,按要求將玻管用銼刀分割成三段,兩端為滴管�,套上橡皮膠頭,留作自己以后實驗用���,為了使橡皮膠頭套上后不易脫落�����,應對滴管端口進行擴口��,方法是將端口移至氧化焰中燒至黃紅色���,快速取出垂直置于石棉網(wǎng)上,適度用力向下壓至端口比原來稍大即可����,此外,滴管尖端也應作熔光處理���,但不能封閉端口����。中間為毛細管���,熔燒封閉一頭后��,可用于以后有機化學實驗中熔點測定時裝樣品用�。彎���、拉玻管實驗成敗的關鍵是掌握好火候和力度��。
五���、玻璃三通管的制作(選做)
分別截取長8cm、5cm玻管各一支�,端口兩頭熔光后,將長玻管中部某一部位置于氧化焰中燒至黃紅色后�,玻管的一頭用手指封住,從另一頭吹氣�,玻管軟化的部位會鼓出一小泡,迅速將端口燒紅的短玻管與之對接上���,若對接不好���,可繼續(xù)加熱接口部位,吹氣直至對接合適為止����。
實驗三氣體的制備與性質(zhì)研究——“氫氣”演示實驗的準備
實驗目的
1�����、掌握實驗室制取氫氣的化學原理和操作方法�;
2����、探索實驗室制取氫氣較為理想的簡易實驗裝置;
3����、掌握氫氣性質(zhì)實驗的演示技能、探索有關實驗的最佳方案�。
實驗原理
Zn+ H2SO4=ZnSO4+H2↑
2H2+O2=2H2O
H2+CuO=Cu+H2O
實驗用品
啟普發(fā)生器、燒杯(500mL����、150mL、50mL)�����、水槽����、橡皮管����、試管及試管架���、玻璃導氣管、玻璃尖嘴管���、鐵架臺(配鐵夾)��、凡士林��、塑料瓶或易拉罐���、玻璃棒、酒精燈����、玻璃絲、火柴�����、蒸發(fā)皿(盛皂液)、石棉網(wǎng)���、洗瓶�����;洗滌劑溶液����、CuSO4溶液����、鋅粒、稀H2SO4(1∶4)�����、甘油���、氧化銅�。
實驗步驟
1.課前寫好預備實驗計劃
在深入鉆研實驗內(nèi)容和相應的課文以及參考資料的基礎上�,寫出預備實驗計劃(要求見實驗一)于實驗之前交指導教師審閱。
2.進行預備實驗
在實驗的過程中,應特別注意總結有關基本操作的規(guī)范化����,演示效果,操作中的安全注意事項����,以及有關實驗的改革方案等。例如�����,注意啟普發(fā)生器的使用、氫氣純度的檢驗,氫氣還原氧化銅實驗等有關操作規(guī)范化的訓練��;氫氣在普通玻璃管嘴上燃燒時�����,其火焰常常為黃色��,可用石英玻璃管嘴或鋁質(zhì)管嘴代替普通玻璃管嘴��,這時氫氣火焰為淡藍色�����,可改善該實驗的效果;由啟普發(fā)生器中導出的氫氣��,若直接點火燃燒�����,假若氫氣不純��,可能引起爆炸事故��?���?蓪С龅臍錃庀韧ㄟ^一個安全燃燒裝置,然后再進行燃燒實驗�����,就不會再有危險�����;用鐵皮罐頭盒做氫����、氧混合氣體的爆炸實驗�����,常使學生產(chǎn)生畏懼心理�?���?蓪㈣F皮罐頭盒改為紙筒,或?qū)溲趸旌蜌怏w鼓入肥皂泡中進行爆炸實驗�����。
3.按以下討論題目寫出書面總結
討論題目:
(1)系統(tǒng)總結氫氣的制法和性質(zhì)實驗的演示技術及安全注意事項�����。
(2)在氫氣的制法和性質(zhì)實驗的演示過程中����,如何對中學生進行安全與
危險的辯證關系的教育�。
參考資料
1.啟普發(fā)生器的結構和用法
啟普發(fā)生器是由球形漏斗1,球形和半球形容器2(又稱底座)和導氣管3等三部分組成(如圖3—1)�����。容器的球形部分有兩個開口,正上方的開口是球形漏斗插入的孔道���,旁邊的一個是氣體的出口��,用橡皮塞連接導氣管�����,半球部分旁側的口是傾倒廢液用的�����,用磨砂玻璃塞塞緊����。球形漏斗的長頸幾乎伸到半球體的底部����,它與球形容器上口的相接處是磨砂的,很密合���,以防漏氣�。
在使用時應先檢查是否漏氣。取下球形漏斗和導氣管上的玻璃活塞��,在其上的磨砂部位涂上一層薄薄的凡士林�����,然后照原樣塞緊����,轉動數(shù)次,打開導氣管上的活塞����,從球形漏斗的上口加入自來水。當水進入容器2并封閉球形漏斗的下口時����,關閉導氣管上的活塞�,再往球形漏斗內(nèi)加水,使球形漏斗中的水位高于容器2中的水位��。靜置數(shù)分鐘��,觀察球形漏斗中的水位是否下降����,若水位下降���,說明漏氣。必須找出原因加以糾正����。倒出自來水,按原樣安裝好�。
把鋅粒裝入啟普發(fā)生器,一般可采用下列手續(xù):先將球形漏斗從容器2中抽出��,把容器2橫放在桌上�����,再把鋅粒從上口放進容器2的球形部分里���,切勿使鋅粒落入容器下部的半球形部分��。然后將球形漏斗按原樣插回�。再把整個裝置直立起來��。這時鋅粒的大小如果適中���,就都嵌在球形漏斗管與容器2頸部之間的縫隙的上面�����。如果此處的縫隙太寬���,為了避免鋅粒下落���,可事先用一塊帶小孔的圓環(huán)形橡皮墊套在球形漏斗管上(或在容器2的頸部填上一些玻璃棉),當將球形漏斗插入容器2時����,使橡皮墊(或玻璃棉)恰好蓋(或填塞)在容器2的頸部。這樣既可阻止鋅粒下落�����,又可以使酸液從小孔(或縫隙)自由通過����。也有人主張拔開帶導氣管3的橡皮塞,從此處裝入鋅粒�����。為了減少酸的用量�����,可在容器2的半球形部分裝入玻璃珠或碎玻璃�����,用以占據(jù)一部分空間�����。制備氣體的操作可按下述步驟進行:裝好鋅粒后����,打開導氣管的活塞,將3mol/L的稀硫酸由球形漏斗注入發(fā)生器����,酸液沿漏斗管流入容器2的半球形部分,再升到中間的球形容器里��。當酸液剛好浸沒鋅粒后����,停止加酸���。這時鋅與酸反應產(chǎn)生氫氣,氫氣由導氣管導出��。如果關閉導氣管的活塞���,生成的氫氣使球形容器里的壓強增大��,將酸液經(jīng)底部半球形容器壓入球形漏斗中����,使酸與鋅粒分開���,反應停止�。用啟普發(fā)生器制備氣體���,有“要用即來�,不用即止”的優(yōu)點�����。凡是用塊狀固體跟液體反應以制備氣體,且反應時不需加熱者�,都可利用啟普發(fā)生器�。
在制取氫氣的過程中,如果中途需要添加鋅粒��,可關閉導氣管上的活塞��,當酸液與鋅粒脫離接觸后����,用橡皮塞將球形漏斗的上口塞緊,再拔下帶導氣管的橡皮塞���。這時由于大氣的壓力��,漏斗中的硫酸不會流入容器2�,所以可將鋅粒從塞導氣管的開口處加入�。加好鋅粒后,塞緊帶導氣管的橡皮塞���,拔下球形漏斗口上的橡皮塞��,即可繼續(xù)使用(須重新檢查氫氣純度)����。如果中途要更換酸液,可在鋅粒與酸液分開(方法如前)的情況下���,用橡皮塞將球形漏斗的上口塞緊����,然后將啟普發(fā)生器放在玻璃水槽或廢液缸的邊沿上���,拔下容器2下部側口的玻璃塞�����,再慢慢地拔開球形漏斗上口的橡皮塞�����,用控制空氣進入球形漏斗的速度來控制廢酸流出的速度�,待廢酸放完后�,塞上容器2下部側口的玻璃塞,再從頂部加入新酸���。
2.有關操作中的一些注意事項
在檢驗氫氣純度時須特別注意的是�,當用試管接向下排空氣法收集氫氣檢驗后,若須再次收集檢驗�,則必須用拇指按住試管口一會兒后再收集,或者換用另一支試管收集�。因為第一次檢驗之后,試管內(nèi)可能仍有氫氣在燃燒(它顏色淺淡����,不易觀察出來)��,若將它立即拿去再收集氫氣����,就會將導氣管口的氫氣點燃。如果這時啟普發(fā)生器內(nèi)的氫氣還未純凈����,就會引起爆炸事故。收集氫氣可用排水法和向下排空氣法����。但用排空氣法難以判斷氫氣是否已經(jīng)收滿,且氣流較小時收得的氫氣常不夠純凈�,故無特別要求時,一般以排水法收集較好��。
在用氫氣流吹肥皂泡的實驗中,肥皂液中不能有固態(tài)微粒存在�。可稱取肥皂或洗衣粉1g于蒸發(fā)皿中�,加蒸餾水30—40ml,使之充分溶和���。為了增加肥皂液的粘性及肥皂泡膜的堅固性���,可再往肥皂液中加入2—3ml甘油。欲要吹出又大又好的肥皂泡���,必須用相當強的氫氣流�����。氫氣流出口處應安裝特別的管嘴�,如尾接管���、球形干燥管����、毛筆的竹制筆帽等�����。口徑宜稍大����,邊緣應平整圓滑。毛筆的竹筆帽是比較理想的管嘴�����。因它的摩擦系數(shù)較大�,吹成的肥皂泡不易在它的上端滑動�,而且它一端的孔較小,另一端(與肥皂泡接觸)較大����,肥皂液沿管的內(nèi)壁逐漸擴大,容易吹成氣泡��,不易破裂��。
使肥皂泡很好地脫離管嘴是實驗成功的又一關鍵���。這步操作可用手輕輕向肥皂泡扇動�,或用嘴輕吹,或抖動一下管嘴等方法�。上述方法如果操作不當,肥皂泡會因受壓不均而破裂�。如果用一支尖嘴玻璃管以水平方向?qū)蕷錃馀菖c管嘴的附著處,輕輕一吹���,(如圖3—2)則因泡只有一小部份受到壓力而易于脫離開來���,用這種方法吹一個成一個。
要使充氫的肥皂泡能上升�����,泡宜大��,膜宜薄���,泡下不掛液滴�,氫氣中應不含或少含水蒸氣�����。氫氣在空氣中燃燒產(chǎn)生淡藍色火焰�����,但如果所用的燃燒管嘴是普通玻璃的,會由于玻璃中的鈉離子而使火焰變成黃色��。為了避免這一弊病�,燃燒的
管嘴可改用石英玻璃管、鋁管等�,且預先用蒸餾水徹底洗凈。為了使罩在火焰上方的燒杯較快地出現(xiàn)水珠�����,所用的燒杯宜稍大一些�����,氫氣流不宜過急����,火焰不宜過大����,否則因溫度迅速升高,水蒸氣不易凝結��。氣溫對這個實驗的效果也有很大的影響,炎夏季節(jié)的實驗效果往往不及嚴冬時的好�。從啟普發(fā)生器中導出的氫氣,如果通過安全燃燒裝置后再點火燃燒��,就可避免因氫氣不純而造成的爆炸危險���。安全燃燒裝置如圖3—2所示�。倒置的漏斗����,其口部邊緣正好浸入水面(不可浸入太深)。漏斗口下方的導氣管端��,必須較深地浸沒在水里����,切勿露出水面。當氫氣由啟普發(fā)生器導出來時����,它冒出水面在漏斗中聚集,然后從漏斗管放出��。估計漏斗中的空氣已經(jīng)排盡(約1—2分鐘)后,即可在連接在漏斗管上的尖嘴管口點火燃燒���。如果氫氣純凈��,自會安靜地燃燒��;即使氫氣不純�����,因漏斗中的混和氣體量較少�����,爆炸時可將封閉漏斗口的水排開也不會發(fā)生危險�����,更不會引起啟普發(fā)生器爆炸���。
|
| 
|
做氫��、氧混和氣體的爆炸實驗所用的集氣瓶應該沒有裂痕或擦傷的痕跡����,且一定要用毛巾包裹����。在移開玻璃片進行燃點時�,必須迅速使瓶口完全敞開。假如玻璃片蓋住半個瓶口����,氣體爆炸時就可能將玻璃片炸碎而傷人。在瓷蒸發(fā)皿或敞口的金屬淺皿中���,盛少量肥皂水(約3—5ml)�,然后將氫氧混和氣體用一支尖嘴導氣管通入其中�,皿內(nèi)就會產(chǎn)生大量的充滿氫氧混和氣體的肥皂泡,用火點燃這些氣泡�,就能聽見響亮的爆炸聲。這個實驗既安全效果又好����。所用的氫氧混和氣體最好由電解水而獲得,因氫����、氧氣體的混和比剛好是2∶1,爆炸力極強,只需少量就能獲得滿意的實驗效果����。制備氫氧混和氣體的裝置如圖3—4所示。接通6—9V的直流電源�����,電解產(chǎn)生的氫氣和氧氣在瓶頸部分混和�����,然后由尖嘴玻璃導管導出�。估計瓶頸部分原有的空氣排盡之后(約1—2分鐘),再將混和氣體通入肥皂液中��。用氫氣還原氧化銅的實驗所用的氧化銅最好少一些����。把它鋪在試管底成一薄層。實驗開始時必須先通入純氫���,將管內(nèi)空氣排盡后才能加熱����,以防氫氧混和氣體燃燒爆炸��。實驗中氫氣要足��,溫度要高����。結束時應先停止加熱,并繼續(xù)通氫�,使生成的銅在氫氣流中冷卻,以免灼熱的銅在空氣中再行氧化����。生成的銅常為紅色粉末狀,不易被學生認別��,但管壁上有一層赤色的有金屬光澤的銅���,則很明顯����。若事先在氧化銅粉末中加少量水并調(diào)成糊狀���,用玻璃棒使之緊附于試管內(nèi)壁(或?qū)⒃嚬軆?nèi)壁盛氧化銅處用少量水使之潤濕�,再加入氧化銅粉末,使之附著在管壁上)�����,然后再如上法通入氫氣使之還原���,會在試管壁上形成光亮的銅鏡��,現(xiàn)象非常直觀��。
3.簡易啟普發(fā)生器的自制
根據(jù)啟普發(fā)生器的原理���,可以自制多種簡易裝置,下列幾種�,是其中的一部分。
 圖3—5A是自制裝置中的一種�����。裝置中的有孔橡皮墊不宜放得太高��,應考慮到酸的總用量以不超過長頸漏斗的總容量為宜����。在圖3—5 B的裝置中�����,試管的底部有一小孔。使用時將試管向下插入���,酸自試管底的小孔進入�。不用時將試管向上提起�����,酸液自會流出�����。在這一裝置中���,固定試管的塞子不宜塞得太緊�,最好在塞子的邊緣留一個缺口���,或用硬紙板固定試管�。在圖3—5 C的裝置中��,帶孔的橡皮墊位置不宜太高,使用時打開彈簧夾使酸跟鋅粒接觸����,不用時關閉,靠氣體的壓力把酸壓到“U”形管的另一臂中��。在圖3—5D的裝置中�,在干燥管內(nèi)放一塊有孔橡皮墊或一團玻璃纖維,再將鋅粒置于干燥管中�����。不用時關閉橡皮管夾��,產(chǎn)生的氫氣將酸從干燥管內(nèi)壓出�,反應就停止了。
圖3—5A是自制裝置中的一種�����。裝置中的有孔橡皮墊不宜放得太高��,應考慮到酸的總用量以不超過長頸漏斗的總容量為宜����。在圖3—5 B的裝置中�����,試管的底部有一小孔。使用時將試管向下插入���,酸自試管底的小孔進入�。不用時將試管向上提起�����,酸液自會流出�����。在這一裝置中���,固定試管的塞子不宜塞得太緊�,最好在塞子的邊緣留一個缺口���,或用硬紙板固定試管�。在圖3—5 C的裝置中��,帶孔的橡皮墊位置不宜太高,使用時打開彈簧夾使酸跟鋅粒接觸����,不用時關閉,靠氣體的壓力把酸壓到“U”形管的另一臂中��。在圖3—5D的裝置中�,在干燥管內(nèi)放一塊有孔橡皮墊或一團玻璃纖維,再將鋅粒置于干燥管中�����。不用時關閉橡皮管夾��,產(chǎn)生的氫氣將酸從干燥管內(nèi)壓出�,反應就停止了。
實驗四“電解水”實驗的準備和演示
實驗目的
1�����、掌握“電解水”演示實驗的操作技能���;
2�、探索電極材料����、電極液濃度及電解質(zhì)種類�����、電壓對水電解效果的影響����;
3����、探索水電解器(霍夫曼電解器)的代用裝置����。
實驗原理
水的電解
陰極反應:2H++2e→H2↑陽極反應:4OH--4e→2H2O+O2↑
總反應:2H2O=2H2↑+O2↑
飽和NaCl溶液的電解
陰極反應:2H++2e→H2↑陽極反應:2Cl--2e→Cl2↑
總反應:2NaCl+2H2O=H2↑+Cl2↑+2NaOH
實驗用品
霍夫曼電解水器、直流低壓電源����、具支U形管、帶刻度試管�����、石墨電極�、鐵電極���、導線、石蠟����、濃H2SO4、固體NaOH�、酚酞試液、淀粉KI試紙����、固體NaCl。
實驗步驟
1.課前寫出預備實驗計劃和演示(試講)計劃鉆研初中化學課本中電解水這個演示實驗的內(nèi)容和相應的課文以及本實驗后列的參考資料�����。根據(jù)中學化學教學大綱的精神分析本實驗在初中化學教材和教學中的地位和作用�����。寫出預備實驗計劃和演示(試講)計劃�,于實驗前交指導教師審閱。預備實驗計劃的要求見實驗一�����,并參閱本實驗的步驟2。演示(試講)計劃相當于教案中教學過程的一個片段��,其內(nèi)容可包括:演示和講授的課題(寫出段落標題)����,如何引入本段課文的講解(寫出引言),如何交待演示實驗的目的(簡述實驗目的)�����,如何安裝儀器并向?qū)W生說明實驗裝置的構造和作用(畫出裝置圖�����,寫出講述要點)��,如何演示及指導學生觀察(簡述操作步驟����,列出觀察要點)�,如何根據(jù)實驗現(xiàn)象分析、歸納得出結論(寫出講授提綱)等�。
2.進行預備實驗
實驗過程中的要求和注意事項同實驗三,且特別要注意本實驗中各實驗裝置、實驗條件和實驗效果的比較和總結�����。
(1)實驗操作及效果的初步體驗
采用霍夫曼電解器作實驗裝置��,以1:10的H2SO4溶液作電解液���,用6V的直流電源進行電解實驗�。觀察和記錄兩極產(chǎn)生氣泡的大小及速度�、收得可檢驗量的氫氣(約15ml)所需的時間、所收得的氫氣和氧氣的體積比以及檢驗氫氣和氧氣的直觀效果�、操作是否簡便等。運用上述裝置��,將直流電壓依次升高到12V和18V分別進行實驗���。注意練習實驗操作����,對比電解速度及直觀效果���。
(2)實驗條件的探索及實驗裝置的代用試驗���。
i���、以1:10的H2SO4溶液為電解液,直流電壓6V����,分別用保險絲(或鉛棒)、石墨捧(干電池芯)����、銅片作電極,依次進行電解實驗�����。觀察和記錄的要求同前�����,并注意相互對比����。
ii�、以10%的NaOH溶液為電解液,直流電壓6V,用鐵釘(或粗鐵絲)作電極進行電解實驗�����。觀察和記錄的要求同前��。改變兩只電極之間的距離(由最遠移到最近�����,但兩極不可相碰而短路)�����,觀察和比較兩電極之間距離的改變對電解速度的影響��。問:如果將電解液稀釋�,電解速度將如何變化?
實驗裝置不變��,將鐵電極先后換成石墨電極和銅片電極��,分別進行電解實驗�,按以上同樣的要求進行觀察和記錄。
通過以上各次實驗�����,試討論小結下列問題:
a、是否用任何材料作電極�����、配以任何溶液作電解液�����,都適用于電解水(證明水的組成)的演示實驗����?
b、影響電解速度的主要因素有哪些����?
c、在某些實驗中��,所得氫氣和氧氣的體積比遠遠偏離2∶1�,其原因何在�����?
d、如果讓你自行設計一種霍夫曼電解器的代用裝置����,原則上應考慮哪些方面的問題���?
iii���、按直觀�、簡單�、安全、可靠等演示實驗的基本條件�,選擇并準備一套電解水的演示實驗裝置以及所需的藥品和材料,供演示(試講)之用���。
3.電解水實驗的演示(試講)
以小組為單位���,在小組內(nèi)輪流演示試講。小組成員互相觀摩���,并進行評議�,提出優(yōu)缺點及改進意見�。
4.按照下列討論題目寫出書面總結
討論題目:
(1)整理實驗記錄��,總結獲得電解水的演示實驗較佳效果的條件��、關鍵和注意事項����。選擇或設計一套較優(yōu)的霍夫曼電解器代用裝置���,畫出裝置圖�,簡述操作步驟及注意事項�,闡明裝置的優(yōu)點或(和)進一步改進的意見。
(2)演示實驗的準備與其后的課堂演示之間的關系如何�?在進行演示的過程中,應遵循哪些基本要求����?試談談你自己的體會。
參考資料
實驗室電解水常用的裝置是“霍夫曼電解器”��,它是由兩支有刻度的玻璃管和一支球形漏斗管用三通管相聯(lián)通而組成的�。兩支刻度玻璃管的上端各有一個活塞,而其下端均嵌有白金電極����。演示前打開兩刻度玻璃管的活塞,往球形漏斗里先倒入濃度為1.5%的硫酸溶液�����,以浸沒兩個鉑電極為度���。再倒入清水���,待兩支刻度玻璃管中的液體即將升到活塞時,加水的速度應放慢����,使液面稍超過兩個活塞,然后將活塞關閉�,伸入卷成細條的濾紙吸去超過活塞部分的水。若用1∶10的硫酸溶液作電解液(不再稀釋)�,可加快電解速度。電解時使用6—18V的直流電源�����,電源的電壓較高時���,電解的速度也較快��。
為了便于檢驗電解所得的氫氣和氧氣�,須在氣體體積大的那支刻度玻璃管(與陰極相連的那一支)的上端,用橡皮管接上一根彎曲的尖嘴管�����;而在另一支刻度玻璃管(與陽極相連的那一支)的上端���,用橡皮管接上一個空的球形干燥管����。檢驗氫氣和氧氣時�����,把帶余燼的木條伸入空的球形干燥管中���,旋開此刻度管上的活塞��,即見木條復燃�����,證明陽極放出的是氧氣���。用干燥的小試管罩在另一支彎曲的尖咀管上��,旋開此刻度管上的活塞,用排空氣法收集氣體�����,移至火焰上燃燒����,以證明它是氫氣。
 用霍夫曼電解器電解水所得的氫氣和氧氣其體積比為2∶1��,用以證明水的組成是較理想的���,但在一般中學�,很難找到這種裝置��。故中學化學教師自制了多種代用裝置���,現(xiàn)選列幾種��,如圖2-1至圖2—3所示�。
用霍夫曼電解器電解水所得的氫氣和氧氣其體積比為2∶1��,用以證明水的組成是較理想的���,但在一般中學�,很難找到這種裝置��。故中學化學教師自制了多種代用裝置���,現(xiàn)選列幾種��,如圖2-1至圖2—3所示�。
注意事項
1.用霍夫曼電解水器時,電解液為5%的H2SO4或5%的NaOH溶液���。
2.實驗完畢��,一定要用水沖洗凈霍夫曼電解水器中殘留的酸堿液���,以免旋鈕被“卡住”。
3.電解水時��,加入的電解質(zhì)并不參與電極反應��,主要是為了增加導電性�����。濃度過低��,達不到效果�,以10%以上為宜。若有低壓直流電源�����,調(diào)高電壓,可縮短演示時間���,通常調(diào)在12~24V之間����。若用干電池����,可4節(jié)串聯(lián)為6V使用����。
4.電解用飽和NaCl溶液在使用前一定要精制,這樣可除去其中的Ca2+�、Mg2+,以避免在陰極附近出現(xiàn)白色混濁現(xiàn)象���。方法是:給盛有36gNaCl的燒杯中加入蒸餾水���,邊加熱邊攪拌,制成飽和溶液�����。待稍冷卻,滴入2滴酚酞試液���,再注入含有NaOH和Na2CO3各2g的混合溶液至堿性�����。靜置數(shù)小時����,待沉淀形成后過濾��,將濾液加熱至沸騰�,稍冷后滴加鹽酸至酚酞剛好變?yōu)闊o色為止。
5.電解NaCl過程中�,在滴入酚酞的溶液表面有時會出現(xiàn)一層白色膠體,這是由于酚酞在飽和溶液中溶解度變小之故���。
實驗五化學定量測定實驗——硝酸鉀在水中的溶解度的測定和溶解度曲線圖的繪制
實驗目的
1���、初步了解中學化學教材中學生實驗的內(nèi)容、要求和特點����。
2��、了解中學化學定量實驗對數(shù)據(jù)的準確度����、精確度及儀器����、藥品的選擇等所規(guī)定的范圍及特殊要求。
3���、熟練掌握本實驗的原理���、操作及教學上的要求�����。
實驗原理
固體的溶解度�,是在一定溫度下,某物質(zhì)在100g溶劑里達到飽和狀態(tài)時所溶解的量(單位為克)����。測定某固體物質(zhì)的溶解度,就需要測知某物質(zhì)在配制成飽和溶液時的溫度�、飽和溶液中某物質(zhì)的質(zhì)量和溶劑的質(zhì)量��。為此���,可以通過兩種途徑來達到。一種是固定溫度�����,測定該溫度下的飽和溶液及其中所含溶質(zhì)(某物質(zhì))的質(zhì)量����。從而計算出這個溫度下的某物質(zhì)的溶解度。這就是溶質(zhì)質(zhì)量法����。另一種是固定溶質(zhì)(某物質(zhì))和溶劑二者的質(zhì)量,測定制成的溶液處于飽和狀態(tài)——開始析出結晶時的溫度��。從而計算出所測溫度下的某物質(zhì)的溶解度�����。這就是結晶析出法�。本實驗測定不同溫度下硝酸鉀在水中的溶解度,根據(jù)實驗目的���,采用了溶質(zhì)質(zhì)量法和結晶析出法�。
實驗用品
儀器
托盤天平(帶砝碼)、燒懷���、試管��、玻璃棒�、溫度計(100℃)����、量筒(10ml)移液管(5ml,帶刻度)����、坩堝鉗、帶圈玻璃攪拌器(大圈)����、帶圈玻璃攪拌器(小圈)��、鐵架臺�、鐵夾、鐵圈�、石棉網(wǎng)���、酒精燈、蒸發(fā)皿�、干燥器(帶干燥劑CaCl2)、洗瓶�����、膠頭滴管��。
藥品
硝酸鉀(已經(jīng)烘去水分并研細)(化學純)
實驗步驟
實驗前認真鉆研初中化學課本中有關這個實驗的內(nèi)容明確該實驗的實驗目的����,了解實驗步驟。然后再進行實驗�。
1.溶質(zhì)質(zhì)量法
(1)稱量蒸發(fā)皿的質(zhì)量
用托盤天平準確稱量一只清潔、干燥的蒸發(fā)皿的質(zhì)量(ml)�����,將稱量的數(shù)值記入表9-1中���。
(2)安裝儀器�,制取指定溫度下的硝酸鉀飽和溶液。儀器安裝下圖��。
用量筒量取10ml蒸餾水����,倒入大試管中。(大試管也可用50ml的小燒杯代替�����,這樣有利于下一步迅速地傾出恒定溫度下的飽和溶液��。如改用小燒杯�����,則需倒入15—20ml蒸餾水�����。)然后把一支溫度計放在試管里�。在一只250ml的燒杯里倒入約150ml水作為水浴。將大試管固定在燒杯中��,使試管內(nèi)的液面低于燒懷中的水面�����,而且試管底不與燒杯底接觸�。安裝完畢,進行水浴加熱����。利用控制水浴溫度,使試管里的溫度保持恒定在指定的溫度(如20℃��、30℃�、40℃、50℃��、60℃����、70℃)。同時逐漸向試管里加入少量硝酸鉀晶體��,邊加邊用玻璃棒充分攪拌����,促使硝酸鉀迅速溶解,直到在恒定溫度下五分鐘內(nèi)不再溶解為止�。這時,溶液已達飽和狀態(tài)。
(3)傾倒溶液�����,稱量(蒸發(fā)皿+飽和溶液)的質(zhì)量��。
在恒溫下靜置�����,待未溶解的硝酸鉀晶體沉到管底后���,取下試管�,把里面澄清的硝酸鉀飽和溶液迅速傾倒在已稱量過的蒸發(fā)皿里(注意���!既不要把未溶解的硝酸鉀晶體倒入蒸發(fā)皿中����,又要防止飽和溶液在流經(jīng)試管中途時溫度下降而析出晶體)��。然后冷卻稱量���,即得(蒸發(fā)皿+飽和溶液)的質(zhì)量(m2)��。把數(shù)值記入表9-1中�。
(4)蒸發(fā)�����、冷卻���、稱量(蒸發(fā)皿+晶體)的質(zhì)量�。
把蒸發(fā)皿放到石棉網(wǎng)上用酒精燈加熱��,邊加熱邊攪拌(注意防止溶液外濺���,或改用水浴加熱)��。待析出晶體較多時�����,改用微火加熱����,繼續(xù)邊加熱邊攪拌(防止晶體外濺)�,直到水分完全蒸發(fā)掉為止(防止強熱使晶體熔融��、分解)��。待稍冷后���,把蒸發(fā)皿放入干燥器中冷卻,冷卻后�,稱量。再重復加熱�、冷卻、稱量�,直到兩次稱量的結果相差不超過0.1g為止,此即(蒸發(fā)皿+晶體)的質(zhì)量(m3)�。把數(shù)值記入表9-l中。
(5)數(shù)據(jù)處理��,計算溶解度
處理以上所測數(shù)據(jù)���,根據(jù)下式計算出硝酸鉀在指定溫度下的溶解度(S)��。把溶解度數(shù)值記入表9—l中����。
計算公式:
以橫坐標表示溫度���,以縱坐標表示溶解度��,根據(jù)本實驗所得數(shù)據(jù)���,繪出
硝酸鉀20℃—70℃的溶解度曲線�����。
2.結晶析出法
按照初中化學課本中編寫的這個實驗的步驟以及下列實驗步驟分別進行實驗,對比它們的優(yōu)缺點��,探索較佳的方法步驟���。
(1)稱取硝酸鉀��,量取溶劑(蒸餾水)
用托盤天平稱取硝酸鉀6.0g�,放入一支清潔�、干燥的試管(35mm×130mm)中。再用移液管準確量取蒸餾水5ml��,注入同一支試管中���。
(2)安裝儀器�,測定硝酸鉀溶液處于飽和狀態(tài)時的溫度
將100℃溫度計和帶圈玻璃攪拌器插入雙孔塞中,再把它們插入試管中�����,并將塞子塞住試管口��。用250ml燒懷盛水約150ml(作水浴用)����。按圖9—2所示裝配儀器。
用酒精燈加熱燒杯�,使試管在水浴里加熱。同時��,上下抽動燒杯中及試管中的玻璃攪拌器�,使杯內(nèi)、管內(nèi)的液體溫度均勻一致并平穩(wěn)上升��,到硝酸鉀晶體全部溶解���,即停止加熱����。將試管取出水浴���,繼續(xù)不斷攪拌�����,讓試管中溶液緩緩降溫�,同時仔細觀察試管中的溶液和溫度計,一旦有晶體出現(xiàn)�,立即記錄開始析出晶體時的溫度。
重復加熱和降溫����,并記錄每次開始析出晶體時的溫度�,到兩次溫度相差不超過0.5度為止。取此兩次溫度的平均值(t)��。
(3)增加溶劑量���,測定稀釋后溶液處于飽和狀態(tài)時的溫度���。
用移液管準確量取蒸餾水1ml,注入試管中����,使試管中的溶劑增加到6ml����。再按上述加熱��、降溫的操作方法���,測定溶劑為6ml時溶液開始析出晶體時的溫度�����。
按同樣操作方法��,每次增加蒸餾水1ml���,依次分別測定溶劑量為7m、l8ml�、9ml、10ml����、11ml、12ml等硝酸鉀溶液(溶質(zhì)都是6g硝酸鉀)在開始析出晶體時的溫度�。直到為30℃或更低溫度時為止。
(4)數(shù)據(jù)處理,計算溶解度
處理實驗所測數(shù)據(jù)��,根據(jù)硝酸鉀和蒸餾水的質(zhì)量以及相應的溫度���,計算出硝酸鉀在不同溫度下的溶解度(S)���。
(5)繪出溶解度曲線
以橫坐標表示溫度,縱坐標表示溶解度�,根據(jù)以上所得的t值和S值,繪出硝酸鉀的溶解度曲線��。
討論總結
按照以下討論題目�����,總結寫出書面報告��。
1. 列表整理實驗記錄�����。根據(jù)你實驗繪制的溶解度曲線與課本中溶解度曲線進行比較���,判斷你的實驗結果的準確程度。根據(jù)你自己實驗中的體會,對比分析“溶質(zhì)質(zhì)量法”和“結晶析出法”的實驗方法�、步驟、裝置�、操作中可能產(chǎn)生誤差的主要因素有哪些?做好本實驗的技術關鍵有哪些����?對初中化學課本中編寫的這個實驗的方法步驟、裝置����、操作有何改進意見?
2.估計中學生按照初中化學課本獨立進行這個實驗時可能發(fā)生的困難��,擬出上課時應向?qū)W生交代的注意事項及課中的巡視指導計劃(計劃內(nèi)容包括重點指導的實驗內(nèi)容����、操作技術和能力的培養(yǎng)等項目)。
實驗六 物質(zhì)的提純——粗鹽的提純
實驗目的
1���、熟練掌握幾種常用儀器的規(guī)范操作技能�。
2����、了解各種常用儀器的使用要求,做到準確,快速地操作儀器��。
3���、能正確使用計量儀器�。
實驗原理
氯化鈉試劑或氯堿工業(yè)用的食鹽水��,都是以粗鹽為原料進行提純的�。粗鹽中除了含有泥沙等不溶性雜質(zhì)外,還含有K+�����、Ca2+�、Mg2+和SO42-等可溶性雜質(zhì)。不溶性雜質(zhì)可用過濾法除去����。可溶性雜質(zhì)中的Ca2+���、Mg2+和SO42-可通過加入BaCl2、�����、NaOH和Na2CO3溶液,生成難溶的硫酸鹽��、碳酸鹽或堿式碳酸鹽沉淀除去�����;也可加入BaCO3固體和NaOH溶液進行如下反應除去:
BaCO3=Ba2++CO32-
Ba2++SO42-=BaSO4↓
Ca2++CO32-=CaCO3↓
Mg2++OH-=Mg(OH)4↓
上述兩種提純方法可由兩位同學合作進行實驗���,最后寫出評述性報告�。
實驗用品
燒杯����、玻璃棒、蒸發(fā)皿����、酒精燈、漏斗�、藥匙、量筒�、鐵架臺(帶鐵圈)、濾紙���、剪刀���、托盤天平�����、粗鹽
實驗步驟
一�、稱取20.0g粗鹽于燒杯中�����,加入約70 cm3水����,加熱攪拌使之溶解。
二����、除Ca2+、Mg2+和SO42-
1.BaCl2-NaOH���,Na2CO3法
(1)除去SO42-
加熱溶液至沸���,邊攪拌邊滴加1mol·dm-3BaCl2盡為止。繼續(xù)加熱煮沸數(shù)分鐘�。過濾。
(2)除Ca2+�、Mg2+和過量的Ba2+
將濾液加熱至沸,邊攪拌邊滴加NaOH-Na2CO3混合液至溶液pH值約等于11���。取清夜檢驗Ba2+除盡后����,繼續(xù)加熱煮沸數(shù)分鐘��。過濾���。
(3)除過量的CO32-
加熱攪拌溶液�,滴加6 mol·dm-3HCl至溶液的pH=2~3�����。
2.BaCO3—NaOH法
(1)除Ca2+和SO42-
在粗食鹽水溶液中�,加入約1.0gBaCO3(比SO42-和Ca2+的含量約過量10%)。在363K左右攪拌溶液20~30min�����。取清夜,用飽和(NH4)2C2O4檢驗Ca2+���,如尚未除盡�,需繼續(xù)加熱攪拌溶液�,至除盡為止。
(2)除Mg2+
用6 mol·dm-3NaOH調(diào)節(jié)上述溶液至pH為11左右���。取其清夜��,分別加入2~3滴6 mol·dm-3 NaOH和鎂試劑�,證實Mg2+除盡后����,再加熱數(shù)分鐘,過濾�����。
(3)溶液的中和
用6 mol·dm-3HCl調(diào)節(jié)溶液的pH=5~6���。
三�、蒸發(fā)���、結晶
加熱蒸發(fā)濃縮上述溶液�����,并不斷攪拌至稠狀�����。趁熱抽干后轉入蒸發(fā)皿內(nèi)用小火烘干���。冷至室溫,稱重�����,計算產(chǎn)率����。
四、產(chǎn)品質(zhì)量的檢驗
取粗鹽和產(chǎn)品各1g左右��,分別溶于蒸餾水中�����。定性檢驗溶液中是否有SO42-、Ca2+和Mg2+的存在��,比較實驗結果�����。
討論總結
1.臺秤的結構及使用方法�。
2.玻璃棒的使用方法。
3.過濾和蒸發(fā)時要注意哪些問題���?
4.在這個實驗里有幾個使用玻璃棒的操作�����,在各個操作中�����,玻璃棒起的作用有什么不同�?
5.在進行過濾時要注意哪幾點�����?為什么?
6.某學生用托盤天平稱取固體食鹽10.6g�,因砝碼和食鹽的位置放倒了,當天平平衡時�,所稱取的固體食鹽的實際質(zhì)量是多少?
實驗七演示實驗的探索——紙上層析
實驗目的
1�、掌握紙上層析的原理、應用����,了解其在中學化學教材中的意義����。
2、探索做好紙上層析演示實驗的技術關鍵�,掌握這個實驗的操作方法。
實驗原理
紙上層析是用濾紙作為支持劑(載體)的一種色層分析法��,這種方法的基本原理一般認為主要是利用混和物中各組分在流動相和固定相間的分配比的不同而使之分離��。
在本實驗中�����,以濾紙上吸附的水為固定相(濾紙纖維常能吸附20%左右的水)�,有機溶劑如正丁醇或乙醇(都含有一定比例的水)等為流動相,酚酞、甲基橙混和物或紅���、藍墨水混和物為層析試樣����。把試樣點在濾紙的原點位置上�����,當流動相溶劑在濾紙的毛細管作用下�����,連續(xù)不斷地沿著濾紙前進通過原點時�,試樣中各組分便隨著流動相溶劑向前移動,并在流動相和固定相溶劑之間連續(xù)發(fā)生一次又一次的分配��。結果�,分配比較大的物質(zhì)移動速度較快,移動的距離較遠���;分配比較小的物質(zhì)移動速度慢�,移動的距離較近����。這樣����,便把試樣中各組分分開聚集在濾紙的不同位置上�����。這種分離過程叫展開���。因此����,流動相溶劑又叫做展開劑�。
當分離的物質(zhì)是有色的�,如甲基橙,層析后在濾紙上可以直接看出它的色斑�。當分離的是無色的物質(zhì),如酚酞�,就必須用顯色劑使之顯色。無色的酚酞可以用氨水使之顯紅色����,所用的氨水就是顯色劑。
紙上層析可用于化學性質(zhì)相近的混和物的分離,特別適宜于微量物質(zhì)的分離和鑒別����。而且使用的儀器簡單,操作比較容易�����,重現(xiàn)性好�。目前,紙上層析已運用到有機化學���、無機化學�����、生物化學及生理學的定性�����、定量分析中����。例如利用紙上層析法使蛋白質(zhì)所包含的幾十種氨基酸在一張濾紙上全部分離開;又如在稀有、稀土����、放射性元素和核裂解產(chǎn)物等的分離和鑒定上���,也用到紙上層析法��,都有較好的效果��。
為了擴大學生的眼界���,提高學生的興趣�����,在中學化學教材中引入了紙上層析實驗�,使學生初步了解用紙上層析分離物質(zhì)的方法�����,但只要求做出定性的結果�。
實驗用品
儀器:
大試管(30mm×200mm)(帶橡皮塞)5支
移液管(10ml)2支
大試管架(大孔)1個
培養(yǎng)皿(直徑8cm)5只
玻璃毛細管(長8cm)2支
剪刀(公用)小刀(公用)
藥品:
酚酞�����、甲基橙混和溶液:配制法是取甲基橙、酚酞各0.1g����,溶于10ml60%乙醇中。
氨水的正丁醇飽和溶液:配制法是先用濃氨水配制成2∶8稀氨水(2ml濃氨水∶8 ml蒸餾水)40ml����,慢慢注入20ml正丁醇中,充分振蕩���。靜置后液體分為兩層���,上層即氨水的正丁醇飽和溶液。
乙醇與氨水的混和溶液:配制法是用乙醇與1mol/L氨水按體積比2∶1(2 ml乙醇∶1ml1mol/L氨水)混和����。
氨化市售白酒:配制方法是用市售白酒與濃氨水按體積比10∶1(10ml市售白酒:1ml濃氨水)混和。
紅藍墨水混合液:配制法是用紅藍墨水按體積比2∶1(2ml紅墨水∶1ml藍墨水)混和��。
材料:
濾紙:圓形(直徑9cm)慢速����、中速、快速定性濾紙各5張��;長條形層析濾紙和中速定性濾紙各5條。
鉛筆(公用)��。
小鐵釘����。
實驗步驟
本次實驗使用兩種不同的層析混和物,四種不同的展開劑��,兩種不同的展開方法和四種不同規(guī)格的濾紙作支持劑��,進行10組(共25次)對比實驗����。
要注意掌握紙上層析的技術,總結本實驗成功的條件����,探索改進實驗的方法。
(一)酚酞和甲基橙混和溶液的紙上層析
1.以氨水的正丁醇飽和溶液作展開劑(氨是顯色劑����。本實驗把顯色劑加在展開劑里��,配成氨水的正丁醇飽和溶液�,目的是為了簡化操作手續(xù)�����,便于使學生直接觀察實驗現(xiàn)象)����。
(1)利用長條形濾紙進行層析(上行展開)分別利用長條形層析濾紙和中速定性濾紙按下列操作進行試驗并對比試驗的效果���。
i.準備:取一支帶橡皮塞(塞子底端中間切有一條縫隙)的清潔�、干燥的大試管(30mm×200mm)����。配合大試管的內(nèi)徑和管長,裁取一長條濾紙���,紙條的寬度比試管的內(nèi)徑略窄(約24mm)�����;長度按塞子底端到近試管底的距離(約180mm)����。(裁取時�,要求濾紙的紙紋均勻一致而且沒有斜紋��;紙面要清潔而平整���;紙邊要剪齊而無紙毛)。
ii點樣:在準備好的長條形濾紙的一端距端邊約2 cm處的正中�����,用鉛筆畫一個小“×”號表示原點的位置�����,于此“×”號處用玻璃毛細管點上酚酞和甲基橙的混和溶液試樣�����,點好的試樣斑點的直徑以不超過0.4cm為宜����。
 iii展開:用移液管量取約10ml氨水的正丁醇飽和溶液,小心地將溶轉移到大試管中(注意:勿使溶液濺到試管上部內(nèi)壁)���。將點好試樣的條形濾紙的另一端夾在橡皮塞底端中間的縫隙里����,然后小心地將濾紙條伸入盛有展開劑的大試管中��,塞上橡皮塞���,使濾紙垂直而兩側不接觸試管內(nèi)壁(否則會造成展開劑不按水平線平行上升����,影響展開效果)���;濾紙條的下端浸入溶液液面下約1cm(勿使試樣斑點浸入溶液之中)�,如下圖���。
iii展開:用移液管量取約10ml氨水的正丁醇飽和溶液,小心地將溶轉移到大試管中(注意:勿使溶液濺到試管上部內(nèi)壁)���。將點好試樣的條形濾紙的另一端夾在橡皮塞底端中間的縫隙里����,然后小心地將濾紙條伸入盛有展開劑的大試管中��,塞上橡皮塞���,使濾紙垂直而兩側不接觸試管內(nèi)壁(否則會造成展開劑不按水平線平行上升����,影響展開效果)���;濾紙條的下端浸入溶液液面下約1cm(勿使試樣斑點浸入溶液之中)�,如下圖���。
塞好(注意密閉?����。┫鹌と?��,將大試管靜置于試管架上,觀察現(xiàn)象�。記錄酚酞與甲基橙完全分離開的時間,以及二者分開后的顏色與相對位置(前后)。
iv結束:取出濾紙條�,立即用鉛筆在展開劑到達的前沿處作一記號。
如果酚酞顯色不鮮明�����,這是因展開劑上升到一定高度��,水分減少�,NH3在無水情況下不能使酚酞顯紅色之故?���?蓪⑷〕龅臑V紙條用水蒸氣熏片刻,然后再用濃氨水熏一下����;或?qū)V紙條倒置(展開劑前沿向下),在展開劑前沿處滴少許氨水�;或事先把濾紙條上部(要控制好上部位置)用水潤濕,待酚酞隨正丁醇上升到被水潤濕處則可顯紅色���。
(2)利用圓形濾紙進行層析(環(huán)形展開或徑向展開)分別用圓形慢速�、中速��、快速定性濾紙按下列操作進行試驗,并對比試驗的效果�����。
i.準備:選好所需規(guī)格的圓形濾紙����,濾紙的直徑應比所用的培養(yǎng)皿(或其它淺皿)的直徑略大�����。再用寬1cm左右的濾紙條卷成直徑為0.15—0.2cm的濾紙芯��。
ii.點樣:取一張選好的(直徑約9cm)圓形濾紙�����,在圓心位置上用玻璃毛細管點上酚酞和甲基橙的混和溶液�,點好的試樣斑點直徑約0.5cm,晾干���。
 iii.展開:在試樣斑點的中心位置上用小鐵釘穿一個小圓孔���,小圓孔的直徑約0.15—0.2 cm�����。取一段長約1.5cm的濾紙芯��,垂直插入小圓孔中��,使濾紙芯的上端稍冒出濾紙平面�����。量取約10ml氨水的正丁醇飽和溶液�,注入直徑為8 cm的培養(yǎng)皿中�����,將準備好的圓形濾紙蓋在培養(yǎng)皿上�,使紙芯下端浸入展開劑中,再罩上培養(yǎng)皿蓋��。如圖6—2所示�����。
iii.展開:在試樣斑點的中心位置上用小鐵釘穿一個小圓孔���,小圓孔的直徑約0.15—0.2 cm�����。取一段長約1.5cm的濾紙芯��,垂直插入小圓孔中��,使濾紙芯的上端稍冒出濾紙平面�����。量取約10ml氨水的正丁醇飽和溶液�,注入直徑為8 cm的培養(yǎng)皿中�����,將準備好的圓形濾紙蓋在培養(yǎng)皿上�,使紙芯下端浸入展開劑中,再罩上培養(yǎng)皿蓋��。如圖6—2所示�����。
靜置���,觀察所發(fā)生的現(xiàn)象���,記錄觀察到的現(xiàn)象和酚酞與甲基橙完全分離的時間�。
iv.結束����、取下圓形濾紙,其后的操作同(一)-1-(1)-iv��。
2.以乙醇和氨水的混和溶液作展開劑(氨是顯色劑)�。
(1)利用長條濾紙進行層析(上行展開)
分別用長條形層析濾紙和中速定性濾紙進行試驗����,并對比試驗的效果。除更換展開劑外����,操作方法同(一)-1-(1)。
(2)利用圓形濾紙進行層析(環(huán)形展開或徑向展開)���。分別用圓形慢速��、中速���、快速定性濾紙進行試驗��,并對比試驗的效果�。除更換展開劑之外��,操作方法同(一)-1-(2)�����。
3.以氨化市售白酒作展開劑(氨是顯色劑)���。(1)利用長條濾紙進行層析(上行展開)分別用長條形層析濾紙和中速定性濾紙進行試驗�����,并對比試驗的效果�。
除更換展開劑之外���,操作方法同(一)-1-(1)�����。
(2)利用圓形濾紙進行層析(環(huán)形展開或徑向展開)分別用慢速��、中速�、快速定性濾紙進行試驗,并對比試驗效果����。除更換展開劑之外,操作方法同(一)-1-(2)���。
(二)紅����、藍墨水混和液的紙上層析�。
1.以市售白酒作展開劑�����。
用紅��、藍墨水混和液作色層分析可不必另行顯色��。(1)利用長條濾紙進行層析(上行展開)����。
分別用長條形層析濾紙和中速定性濾紙進行試驗���,并對比試驗的效果。除更換層析混和物及展開劑之外����,操作方法同(一)-1-(1)。
(2)利用圓形濾紙進行層析(環(huán)形展開或徑向展開)��。
分別用圓形慢速�、中速、快速定性濾紙進行試驗�����,并對比試驗效果��。除更換層析混和物及展開劑之外�,操作方法同(一)-1-(2)。
2.以氨化市售白酒作展開劑�����。
(1)利用長條形濾紙進行層析(上行展開)分別用長條形層析濾紙和中速定性濾紙進行試驗���,對比試驗效果����,并注意與使用未氨化的市售白酒作展開劑的實驗效果對比。除更換層析混和物及展開劑之外�����,操作方法同(一)-1-(1)�。
(2)利用圓形濾紙進行層析(環(huán)形展開或徑向展開)。
分別用圓形慢速����、中速、快速定性濾紙進行試驗����,對比試驗效果,并注意與使用未氨化的市售白酒作展開劑的實驗效果對比�����。除更換層析混和物及展開劑之外��,操作方法同(一)-1-(2)���。
 以上實驗內(nèi)容歸納如下表�。
以上實驗內(nèi)容歸納如下表�。
討論總結
根據(jù)以下討論題目���,總結寫出書面報告��。并附交一份你這次實驗中較好的層析作品���。
1.根據(jù)你在以上各次紙上層析實驗中的操作條件(包括層析混和物、展開劑�、顯色劑、濾紙的選擇����、展開方法等)及實驗效果(包括混和物分離的時間、分開后的顏色和相對位置等)��,列表(自行設計)整理實驗記錄��,對比總結兩種展開方法的優(yōu)缺點�,分析選擇出較佳的實驗條件。你認為做好紙上層析演示實驗應注意哪些事項���?
2.根據(jù)你自己實驗的體會��,對中學化學課本中所述紙上層析演示實驗的
步驟和操作方法提出你的看法����。
3.本實驗把顯色劑加在展開劑中,對實驗效果有無影響�����?(可進一步實
驗驗證)���。
4.你認為在中學演示紙上層析實驗時��,還可采用其它哪些層析混和物�����、
展開劑��、顯色劑�����、更為簡便易行并得到良好的效果�����。
實驗八“阿佛加德羅常數(shù)的測定(單分子膜法)”學生實驗的準備和探索
實驗目的
1���、探討“單分子膜法測定阿佛加德羅常數(shù)”實驗在中學化學教材中的地位和作用。
2���、探討“單分子膜法測定阿佛加德羅常數(shù)”實驗的關鍵��,掌握該實驗的操作方法和技能�。
3���、學習“單分子膜法測定阿佛加德羅常數(shù)”的原理和實驗數(shù)據(jù)的測定及計算的講解方法�����。
實驗原理
 本實驗是根據(jù)硬脂酸能在水的表面上形成一層單分子膜的性質(zhì)而設計的����。硬脂酸易溶于苯��,難溶于水�����,而苯又難溶于水且易揮發(fā),當把極稀的硬脂酸的苯溶液逐滴滴入圓形水槽中的水面上時�����,硬脂酸的苯溶液就在水面上向四周擴散���,同時苯不斷揮發(fā)�����,留下來的硬脂酸分子(C17H35COOH)隨即在水面作定向而整齊的緊密排列�����。硬脂酸分子中親水的極性基團(羧基—COOH)這一端向下插入水面�����,分子中疏水的非極性基團(烴基—C17H35)作為另一端直立向上���,從而在水面上形成硬脂酸單分子膜的覆蓋層,如圖8—1所示����。根據(jù)本實驗所配硬脂酸苯溶液總體積V(ml)中含有硬脂酸的質(zhì)量mg����,本實驗測得形成單分子膜時滴入硬脂酸苯溶液的滴數(shù)d和每滴的體積Vd(ml)��,以及圓形水槽的內(nèi)徑D(cm)�����,又已知每一個硬脂酸分子的截面積A(A=22×10-16cm2)和1mol硬脂酸分子的質(zhì)量M(M=284.47g)���,就可按下列公式計算出1mol硬脂酸所含的分子數(shù),即阿佛加德羅常數(shù)NA
本實驗是根據(jù)硬脂酸能在水的表面上形成一層單分子膜的性質(zhì)而設計的����。硬脂酸易溶于苯��,難溶于水�����,而苯又難溶于水且易揮發(fā),當把極稀的硬脂酸的苯溶液逐滴滴入圓形水槽中的水面上時�����,硬脂酸的苯溶液就在水面上向四周擴散���,同時苯不斷揮發(fā)�����,留下來的硬脂酸分子(C17H35COOH)隨即在水面作定向而整齊的緊密排列�����。硬脂酸分子中親水的極性基團(羧基—COOH)這一端向下插入水面�����,分子中疏水的非極性基團(烴基—C17H35)作為另一端直立向上���,從而在水面上形成硬脂酸單分子膜的覆蓋層,如圖8—1所示����。根據(jù)本實驗所配硬脂酸苯溶液總體積V(ml)中含有硬脂酸的質(zhì)量mg����,本實驗測得形成單分子膜時滴入硬脂酸苯溶液的滴數(shù)d和每滴的體積Vd(ml)��,以及圓形水槽的內(nèi)徑D(cm)�����,又已知每一個硬脂酸分子的截面積A(A=22×10-16cm2)和1mol硬脂酸分子的質(zhì)量M(M=284.47g)���,就可按下列公式計算出1mol硬脂酸所含的分子數(shù),即阿佛加德羅常數(shù)NA
圖8—1硬脂酸分子在水的表面層上定向排列形成單分子膜的示意圖
此計算公式可從下列分步計算推導得出�����。
計算水槽里水面上形成的單分子膜中所含硬脂酸的分子個數(shù)(n)��。

覆蓋在水槽中整個水面上的硬脂酸單分子膜的面積����,相當于水槽中水的表面積S(cm2),可由本實驗測得水槽內(nèi)徑D計算出:

2.計算水槽里水面上形成的單分子膜中所含硬脂酸的質(zhì)量W
W=每滴硬脂酸苯溶液所含硬脂酸的質(zhì)量×(滴數(shù)-1)����。
(從總滴數(shù)中減去1����,是因為最后一滴沒有擴散����,也就是沒有參加形成單分子膜。)
計算每一個硬脂酸分子的質(zhì)量W′��。
將“阿佛加德羅常數(shù)的測定”實驗選入高中化學課本�,目的在于使學生通過實驗,了解阿佛加德羅常數(shù)的一種測定方法和原理���,從而能更深刻地認識阿佛加德羅常數(shù)的意義和自覺地運用這個常數(shù)去理解有關的化學基本概念并進行化學計算�。同時��,也有助于提高學生的分析推理能力和學習定量地研究化學的方法���。
實驗用品
儀器
分析天平一臺
稱量瓶一只
燒杯(50ml)一只
玻璃棒一根
容量瓶(250ml)一只
膠頭滴管(60—80滴/ml)��,或移
液管(5ml��、帶刻度�����、帶膠頭)一支
膠頭滴管(>130滴/ml)��,或一支
醫(yī)用注射器(10—20ml)
玻璃水槽(圓形�����、直徑約33cm左右)一只
培養(yǎng)皿(直徑9cm)一只
直尺一把
卡尺一把
量筒(5ml或10ml����,0.1ml刻度)一只
藥品
硬脂酸(分析純)
苯(分析純�,經(jīng)過無水氯化鈣處理)
實驟步驟
1.硬脂酸苯溶液的制備在分析天平上用50ml小燒杯稱取約50—100mg硬脂酸,以少量苯溶解后����,注入250ml容量瓶中,用苯?jīng)_洗燒杯數(shù)次�����,洗滌液均倒入容量瓶中����,最后再往容量瓶中加苯至刻度,配成250ml硬脂酸苯溶液�����。
2.準確測定每滴硬脂酸苯溶液的體積取一支清潔干燥的膠頭滴管(60—80滴/ml),吸入硬脂酸苯溶液��,往小量筒中滴入100滴�����,讀出它的體積數(shù)(估計到小數(shù)點后兩位)�。并計算出一滴硬脂酸苯溶液的體積Vd(ml)。再重復操作兩次���,取三次結果的平均值����。滴時要注意使滴管垂直���,并避免空氣回吸���。
 3.準確測定圓形水槽中水的表面積往圓形水槽中加水至水槽高度的1/2~1/3,并把它放平�。在水面的位置做上標記,然后用卡尺沿水面從三個不同方位準確量出水槽內(nèi)徑,取其平均值D(cm)���。計算出水槽內(nèi)水的表面積:
3.準確測定圓形水槽中水的表面積往圓形水槽中加水至水槽高度的1/2~1/3,并把它放平�。在水面的位置做上標記,然后用卡尺沿水面從三個不同方位準確量出水槽內(nèi)徑,取其平均值D(cm)���。計算出水槽內(nèi)水的表面積:
把水槽中的水倒掉�,用去污粉(必要時用碳酸鈉)擦洗水槽內(nèi)壁�����,用清水沖洗干凈后��,重新往水槽中注入清水至標記處�。
4.準確測定在水面上形成硬脂酸單分子膜需要滴入硬脂酸苯溶液的滴數(shù)�����。用上述膠頭滴管吸取硬脂酸苯溶液���,使滴管垂直���,保持在水槽的中心位置上方,且管尖離水面約5cm高�����,往水面上滴入一滴硬脂酸苯溶液。仔細觀察�,待滴到水面上的硬脂酸苯溶液全部擴散和苯已揮發(fā)而看不到珠滴時(不得用嘴吹),再滴入第二滴�����。如此逐滴滴入���,直到滴入一滴后��,硬脂酸苯溶液在水面上不再擴散而呈透鏡狀油珠����,并在半分鐘內(nèi)都不消失時����,表示硬脂酸單分子膜已經(jīng)形成并完全覆蓋水面,遂停止滴入�����。記下滴入的滴數(shù)d���。在每次吸取硬脂酸苯溶液后�����,要立即蓋上盛硬脂酸苯溶液的試劑瓶的瓶塞���,避免苯揮發(fā)使溶液濃度發(fā)生變化�。滴液時���,捏膠頭的力要均勻�,避免空氣回吸��。
重復測定:把水槽中的水倒掉���,用Na2CO3粉擦洗水槽�,洗去粘在水槽上的硬脂酸(為什么一定要洗去���?),用清水仔細沖洗干凈后����,再往水槽中注入清水至標記處。重復以上操作�����,再做兩次實驗,取三次結果的平均值��。
5.數(shù)據(jù)處理
根據(jù)測得的數(shù)據(jù)�,算出阿佛加德羅常數(shù)。
6.用一支每ml大于130滴的膠頭滴管(或注射器)和上面實驗用的圓形水槽重復實驗步驟2—5���,進行實驗����。
7.用一只較小的客器(如培養(yǎng)皿)���,分別用每ml60—80滴的膠頭滴管和每ml大于130滴的膠頭滴管(或注射器)重復做這個實驗��,探討容器的大小和每滴硬脂酸苯溶液體積的大小對實驗結果的影響����。
實驗記錄及數(shù)據(jù)處理結果可填入下表�。
討論總結
按照以下討論題目,總結寫出書面報告�����。
1.列表整理實驗記錄,處理實驗數(shù)據(jù)����。對比并總結容器的大小和每滴硬脂酸苯溶液體積的大小對實驗結果的影響。
2.分析造成實驗誤差的因素�����,指出做好本實驗要注意的問題�����。
3.扼要敘述你對本實驗在中學化學教學中的地位和作用的認識���。如何向中學生講解本實驗原理�,提出你的講授綱要�����。
注意事項
1.在單分子膜法中�,配制的硬脂酸苯溶液的濃度應在20 mg/100mL左右��,不能太大�;水槽一定要干凈��,不能有油脂和堿存在���,洗滌時不能用合成洗滌劑,否則苯溶液會慢慢爬到上部器壁���,使d值增大���,造成較大的誤差;往水槽里滴入硬脂酸苯溶液時�����,一定要等苯揮發(fā)后����,再滴下一滴,尤其是最后1~2滴溶液擴散得很慢����,必須耐心觀察。當最后一滴滴下后����,它在水面呈透鏡狀�,不發(fā)生擴散�����,也就沒有參與單分子膜的形成�����。故在計數(shù)時����,將這最后一滴減掉,記為d-1�。
2.電解法中,銅片電極洗凈后����,就不能再用手指觸及,以免電極沾上油污����,影響銅電解時析出;電解溫度控制在20~25℃之間��,在整個電解過程中��,可通過調(diào)節(jié)電阻����,使電流強度盡可能保持不變;
3.電解時若無副反應�����,則Δm=Δm′�����,銅片增����、減質(zhì)量為Δm/63.5mol和Δm′/63.5mol,陰陽極通過的電量為It��。一個銅離子所帶電量為2×1.6×10-19C��,則1mol銅所含原子數(shù)(NA)可用上表中的公式計算得到��。
實驗九 堿金屬及其化合物的性質(zhì)實驗
實驗目的
1.熟練掌握堿金屬及其化合物的性質(zhì)實驗操作技能����。
2.學會堿金屬及其化合物的性質(zhì)實驗教學方法��。
實驗用品
鑷子����、小刀��、放大鏡����、鋁箔、燃燒匙�、酒精燈、燒杯����、試管、脫脂棉����、玻璃管、滴管����。
蒸餾水、煤油、石灰水��、酚酞試液����、鉀�����、鈉��、過氧化鈉���、碳酸鈉���、碳酸氫鈉、草木灰���、稀鹽酸����、氯化鋇溶液�����、硝酸溶液、稀硝酸�。
實驗步驟
1.鈉與氧的反應
用鑷子從瓶中取出小塊金屬鈉,并用濾紙吸干其表面的煤油�����,用刀切去一端的外皮��、觀察鈉的顏色���。并注意斷面上所發(fā)生的變化����。把外面的氧化膜切去后���,放在燃燒匙里加熱����,觀察觀象���。
2.鈉與水的反應
向一盛有水的燒杯里�����,投進一小塊金屬鈉(綠豆大小)�����,仔細觀察現(xiàn)象��。然后滴加幾滴酚酞溶液�����,溶液顏色有何變化�����。
3.鉀與水的反應
從煤油里取出一塊金屬鉀���,用濾紙吸干煤油,切取綠豆大小的鉀�����,放在盛有冷水的燒杯里�,迅速用玻璃片蓋好(以免因輕微爆炸而飛濺出液體)。反應完后滴入幾滴酚酞溶液,觀察溶液顏色的變化��。與上述實驗現(xiàn)象比較���,可得出什么結論�。
4.過氧化鈉與水反應
向1支潔凈干燥的試管中加入一藥匙過氧化鈉固體粉末��,然后再向試管中滴加蒸餾水����,觀察有無氣泡放出。若有�,用拇指堵住試管口,用帶火星的木條檢驗�����,以證實是否是氧氣放出
5.碳酸鈉和碳酸氫鈉
(1)與酸反應
分別向兩個干凈的大試管里各加入一藥匙碳酸鈉和碳酸氫鈉����,然后分別滴加6mol·L-1稀鹽酸5毫升,比較兩支試管中放出二氧化碳氣體的快慢程度�����。
(2)熱穩(wěn)定性
把2g碳酸鈉放入試管里,并往燒杯里倒入新制的澄清石灰水����,加熱,觀察澄清的石灰水是否變混濁�。把試管拿掉,換一支盛有同樣體積碳酸氫鈉的試管�����,加熱�,再觀察澄清石灰水是否變混濁。
6.從草木灰中提取鉀鹽
(1)溶解 在250mL燒杯里放入半燒杯草木灰�����,加水至高出灰面1~2cm處����,放在石棉網(wǎng)上���,用小火加熱�����,且用玻璃棒攪動����,以加速草木灰中鉀鹽的溶解。
(2)過濾 把燒杯中的草木灰和浸液一起過濾����,如果濾液混濁再過濾一次,直至濾液澄清��。
(3)蒸發(fā) 把濾液倒入蒸發(fā)皿中����,加熱蒸發(fā),直至只剩少量液體時停止加熱���。
(4)冷卻 靜止片刻可見溶液中有鉀鹽晶體出現(xiàn)�。
(5)碳酸根離子��、硫酸根離子�����、氯離子的檢驗 取制得少量晶體放入試管里����,加蒸餾水溶解并把溶液分成三份�����,分裝在三支試管里����,依次編號為1���、2�、3��。在1號試管里加入鹽酸���,在2號試管里加入氯化鋇溶液,再加入鹽酸����,在3號試管里加入硝酸銀溶液,再加入稀硝酸����,分別觀察現(xiàn)象���。根據(jù)上述現(xiàn)象,可以驗證溶液里含有哪些離子�。 實驗改進
1.鈉與氧氣反應
加熱試管里的高錳酸鉀固體使其分解,再給彎管(彎管直徑應粗一些)里的鈉加熱����,可看到鈉劇烈燃燒,發(fā)出亮黃色的火焰����,同時生成淡黃色的過氧化鈉。
2.鈉與水反應
在試管中水面上加一層2~3cm厚的煤油����,將一小塊鈉(3~4mm見方)放進試管,由于ρ煤油<ρ鈉<ρ水���,所以鈉將沉于煤油而浮于水面�����,但不要使鈉塊頂部露在煤油外����。用手持放大鏡在試管側面觀察這一反應是非常有趣的。
3.過氧化鈉與水�����、二氧化碳的反應
在一小團脫脂棉上����,放兩藥匙過氧化鈉粉末,然后包起來�����,留有一個小縫隙��,放在蒸發(fā)皿里��,用膠頭滴管向脫脂棉的縫隙內(nèi)的過氧化鈉上慢慢滴幾滴水���,一會兒���,脫脂棉便燃起來�。此實驗證明:過氧化鈉和水反應能放出氧氣且是放熱反應。
在上法中改用玻璃管對著過氧化鈉吹氣�����,棉花也會燃燒起來,這時過氧化鈉能和呼出的二氧化碳起反應放出氧氣且放出熱量���。
問題與研究
1.草木灰包括草本灰和木本灰�����。草本灰的顏色為深灰色或黑色��,密度較小�,碳酸鉀的含量較低����,濾下的灰水為黃色。木本灰顏色較淺���,密度較大����,碳酸鉀含量較高�����,濾下的灰水為紅棕色。
2.草木灰里一般含有三種鉀鹽�,即碳酸鉀、硫酸鉀�����、氯化鉀����。隨灰粉的來源不同,三種鉀鹽的含量也有所不同����。
常見作物的草木灰中三鉀的含量
灰的種類
| 含鉀鹽(以K2O計)質(zhì)量(%)
|
向日葵桿灰
| 36.3
|
玉米桿灰
| 17.2
|
木柴桿灰
| 16.2
|
稻草桿灰
| 8.1
|
3.鈉與水反應可以觀察到哪些現(xiàn)象?
4.設計一套簡易裝置��,既能觀察到鈉與水的反應現(xiàn)象�����,又能迅速驗證放出的氣體是氫氣的實驗裝置���。[參閱:熊言林.鈉跟水組合實驗新設計.化學教學����,2003,(7~8):14]
5.為什么和鹽酸反應碳酸氫鈉比碳酸鈉劇烈���?
6.通過實驗探究����,設計一套實驗裝置����,既能進行過氧化鈉與水反應,又能進行過氧化鈉與二氧化碳反應的實驗���。
實踐活動
[想一想]
1.在過氧化鈉與二氧化碳的反應中��,僅僅是其二者反應嗎�?水份有沒有起到作用��?怎樣證明�?
[做一做]
1.請設計一個簡單實驗,說明鈉在空氣中燃燒生成了過氧化鈉����。
實驗十 生活化學實驗——豆腐中鈣質(zhì)和蛋白質(zhì)的檢驗
實驗目的
1�����、了解豆腐的主要化學成分�;
2����、使學生能運用化學知識解決日常生活中的化學問題。
實驗用品
燒杯�、漏斗、濾紙�、鐵架臺(帶鐵圈)、精密pH試紙�、草酸鈉、濃硝酸�����。
實驗原理
豆腐中的鈣質(zhì)與草酸鈉溶液反應便生成不溶于水的草酸鈣白色沉淀�����。
Ca2++Na2(COO)2→Ca(COO)2↓+2Na+
蛋白質(zhì)遇到濃硝酸����,微熱后呈黃色沉淀析出�����,冷卻后再加入過量的氨水���,沉淀就變成橙黃色�����。因為蛋白質(zhì)分子中一般有帶苯環(huán)的氨基酸�,濃硝酸和苯環(huán)發(fā)生硝化反應,能生成黃色的硝基化合物����,故可用來檢驗蛋白質(zhì)。
實驗步驟
1.豆腐的酸堿性試驗
取200克豆腐放入燒杯中��,加入20毫升蒸餾水�����,用玻棒攪拌����,并搗碎到不再有塊狀存在���。過濾,得到無色澄清的濾液和白色的濾渣�。用精密pH試紙測試豆腐濾液的酸堿性(一般測得的pH值為6.2,顯弱酸性)�����。
2.豆腐中鈣質(zhì)的檢驗
取上述豆腐濾液2毫升于試管中��,再滴入幾滴濃草酸鈉溶液�,試管中立即出現(xiàn)明顯的白色沉淀。說明豆腐中含有豐富的鈣質(zhì)���,而且能溶于水�,不一定與蛋白質(zhì)結合在一起�����。
3.豆腐中蛋白質(zhì)的檢驗
取上述白色的豆腐濾渣少許���,放入試管中��,再滴入幾滴濃硝酸�,然后微熱,可以看到白色的豆腐濾渣變成黃色�����。冷卻后����,加入過量的氨水,黃色轉變成橙黃色��,這就是蛋白質(zhì)的黃色反應�。
注意事項
1.在制豆腐濾液前�����,一定要把豆腐搗碎����,才能使鈣離子溶解到水中。
2.由于豆腐中含有較多蛋白質(zhì)��,形成膠體�����,故過濾較慢。但蛋白質(zhì)一般不易透過濾紙�����,所以濾液不會有黃色反應��。
實驗十一生活化學實驗——香煙煙霧中幾種毒物的測定
實驗目的
使學生了解香煙的有害成分�,從而樹立吸煙有害健康的正確觀念。
實驗原理
根據(jù)科學家實驗統(tǒng)計����,香煙煙霧中有一千多種化合物,其中至少有三百種化合物在不同程度上有毒�����,如一氧化碳�,尼古丁、醛類等��。有的還具有致癌作用���,如聯(lián)苯胺�����、亞硝胺�、3,4-苯并芘等�。本實驗僅檢驗一氧化碳、尼古丁和醛類�����。一氧化碳可與鮮血中的血紅蛋白結合�,這時血紅色的血液會變成鮮紅色,表示血液中毒�。尼古丁又叫煙堿��,煙堿遇氯化汞溶液會產(chǎn)生白色沉淀。醛類可通過銀鏡反應來檢驗���。
實驗用品
具支試管(或者W管),棉花���、普通香煙��,帶過濾嘴香煙�����、煙嘴���。95%酒精��、新鮮動物血����、2N氯化汞溶液�����、2%硝酸銀溶液�、2%氨水。
實驗步驟
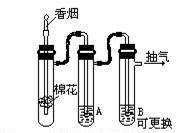 1.一氧化碳的毒性檢驗裝置如圖11-11�。
1.一氧化碳的毒性檢驗裝置如圖11-11�。
圖11-11
在B管中加入5毫升新鮮的動物血(雞、鴨等家禽的血都可)����,加少量苯酸鈉作抗凝劑,用吸濾氣唧抽氣����,點燃香煙裝入煙嘴,使香煙的煙霧通過A管(其中盛入1/3管蒸餾水,再通入B管�。當點燃到第三支香煙時,血液可明顯的看出由血紅色逐步變成鮮紅色�,這說明一氧化碳與鮮血中的血紅蛋白結合。
2.尼古丁的檢驗 把B管換成10毫升95%的酒精�����,用吸濾氣唧抽氣���,點燃香煙裝入煙嘴�,香煙的煙霧通過B管��,當點燃到第三支香煙時����,可看到酒精的顏色逐漸變?yōu)辄S色,當點完第七支香煙時����,溶液可變?yōu)楹稚?���。取下B管,倒2毫升褐色溶液于另一試管中,再滴入3滴2N氯化汞溶液��,立即生成白色沉淀�����,這說明有尼古丁存在�����。
3.醛類的檢驗 取下試管A��,倒5毫升溶液于另一試管中��,加2毫升銀氨溶液�����,放在水浴中微熱�����,可觀察到有銀鏡生成����。
用帶有過濾嘴的香煙代替普通香煙���,做同樣的試驗以作對比。
注意事項:
1.所有塞子和香煙插入處��,不應漏氣��。
2.實踐證明����,有過濾嘴和沒有過濾嘴的香煙,其煙霧沒有明顯區(qū)別�,說明過濾嘴僅能濾掉微粒而濾不掉有毒氣體
實驗探討
1、酸性高錳酸鉀腿色���,是因為煙氣中含有醛基還原性物質(zhì)�。如丙烯醛��,它可抑制氣管纖毛將分泌物從肺內(nèi)排出��,給吸煙者帶來呼吸困難�,發(fā)展成慢性支氣管炎和肺氣腫。
2�����、動物血為鮮紅色�����,是因為煙氣中含有一氧化碳���,極易與血紅蛋白結合����,但卻不易分離���。所以一氧化碳進入人體后會阻礙氧與血紅蛋白的結合���,使人體血液缺氧而中毒。
3����、蒸餾水和乙醇變渾濁,是因為煙氣中有極微小的不溶固體顆粒�����。煙氣中的尼古丁易溶于乙醇中��,氫能與HgCl2生成白色沉淀,尼古丁是煙草中的特性物質(zhì)�,能使人引起多種疾病,其最大的危害在于使吸煙者成癮�。通過煙氣的水溶液能用于銀鏡反應,說明煙氣中含有醛類物質(zhì)�。
4、若支管內(nèi)不加任何實際�����,用洗耳球反復吸煙�����,擠捏洗耳球時���,噴出大量白煙��。一支香煙未燃盡����,就可看到支管內(nèi)出現(xiàn)黃褐色物質(zhì)�,這是煙焦油,對人體危害極大���。
實驗十二氣體的制備與性質(zhì)研究——甲烷的制法與性質(zhì)
實驗目的
1���、掌握實驗室制取甲烷的反應原理和實驗方法。
2����、試驗甲烷的性質(zhì)。
3����、掌握甲烷的制備和性質(zhì)實驗的成功關鍵和演示方法。
實驗原理
CH3COONa+NaOH=Na2CO3+CH4↑
CH4+2O2=2H2O+CO2
CH4+2Cl2=4HCl+C
主要材料與試劑
鐵架臺�、酒精燈、托盤天平��、研缽����、水槽、坩堝鉗��、蒸發(fā)皿���、鋁箔�����、脫脂棉���、鑷子����、藥匙�、石棉網(wǎng)、玻璃棒��、火柴����、集氣瓶、玻璃片�、無水醋酸鈉、堿石灰�、NaOH、生石灰�����、Fe2O3、KMnO4�����、MnO2�����、濃鹽酸�����、溴水�、濃氨水�����、澄清石灰水���。
實驗步驟
1.寫出預備實驗計劃課前按照上列的實驗題目����,對照并深入鉆研高中化學課本中相應的演示實驗內(nèi)容和有關課文����,參閱本實驗后列的有關參考資料���,寫出預備實驗計劃(要求同前),交指導教師審閱���。
2.進行預備實驗
在本次實驗中�,應特別注意甲烷在制法和性質(zhì)方面的特點����、通過實驗注意掌握甲烷、實驗的演示要點和成功關鍵�����。
3.根據(jù)討論題目寫出書面總結
討論題目:
(1)做好甲烷實驗的演示要點和成功關鍵����。
(2)根據(jù)有機化學反應的特點,演示有機化學實驗時應注意哪些問題�。
參考資料
1.甲烷的制備
在制備甲烷的裝置中,盛無水醋酸鈉和堿石灰的試管其管口必須稍低于管底�����,否則,凝聚的水倒流�����,會使灼熱的試管炸裂��。所用的堿石灰必須是干燥的�����。堿石灰中的消石灰并不直接參加反應����,加入消石灰的目的是為了吸濕���,防止氫氧化鈉潮解�,這樣有利于甲烷的生成�。
如果沒有堿石灰,可以自制��。其制法是在鐵制容器或瓷蒸發(fā)皿中����,放入2份
重量的生石灰粉末和1份重量飽和的燒堿溶液,充分混和然后加熱蒸發(fā)至干,再繼續(xù)煅燒數(shù)分鐘后�,研碎,即得堿石灰�。貯于干燥的瓶中備用?����;蛘?����,取二份重量的未吸水的塊狀生石灰��,研成粉末�����,與一份重量的粒狀NaOH混和���,現(xiàn)和現(xiàn)用�����,效果很好���。
如果實驗室只有結晶醋酸鈉(CH3COONa·3H2O)���,可將結晶醋酸鈉放在蒸發(fā)皿中加熱除去結晶水。結晶醋酸鈉的熔點是58℃�,在123℃失去結晶水。
 因此�����,當加熱到58℃時�����,開始熔化為液體�。這時���,晶體容易向外飛濺�,操作時要用玻璃棒不斷攪拌��,使它受熱均勻�。當加熱到123℃時開始失去結晶水,慢慢地由液體變?yōu)榉勰畹臒o水醋酸鈉���。到氣泡停止時�,應停止加熱,但仍須繼續(xù)攪拌�,至冷卻為止,避免結成硬塊粘結在蒸發(fā)皿內(nèi)�����。制得的無水醋酸鈉應研細后貯藏于密閉的瓶中備用�。市售的無水醋酸鈉也難免吸有水分,使用的前一天應重新加熱進行除水處理����,反應物是否干燥無水,是本實驗最重要的成敗關鍵之一���。醋酸鈉與堿石灰反應�,必須加熱才能發(fā)生�����。但過份的強熱會發(fā)生副反應�����,生成丙酮、乙烷����、不飽和烴以及二氧化碳等物質(zhì)。例如:
因此�����,當加熱到58℃時�����,開始熔化為液體�。這時���,晶體容易向外飛濺�,操作時要用玻璃棒不斷攪拌��,使它受熱均勻�。當加熱到123℃時開始失去結晶水,慢慢地由液體變?yōu)榉勰畹臒o水醋酸鈉���。到氣泡停止時�,應停止加熱,但仍須繼續(xù)攪拌�,至冷卻為止,避免結成硬塊粘結在蒸發(fā)皿內(nèi)�����。制得的無水醋酸鈉應研細后貯藏于密閉的瓶中備用�。市售的無水醋酸鈉也難免吸有水分,使用的前一天應重新加熱進行除水處理����,反應物是否干燥無水,是本實驗最重要的成敗關鍵之一���。醋酸鈉與堿石灰反應�,必須加熱才能發(fā)生�����。但過份的強熱會發(fā)生副反應�����,生成丙酮、乙烷����、不飽和烴以及二氧化碳等物質(zhì)。例如:
這些生成物����。在試驗甲烷的性質(zhì)時,使甲烷的火焰出現(xiàn)丙酮的焰色���,以及使溴水或高錳酸鉀溶液褪色等�����,造成實驗現(xiàn)象異常�����。因此��,在制備甲烷時,最好把生成的氣體先后通過堿溶液和濃硫酸的洗氣瓶���,以洗掉這些雜質(zhì)�����,然后再行使用����,或貯存在貯氣瓶里備用。2.甲烷的性質(zhì)試驗甲烷的穩(wěn)定性�,可將甲烷通入高錳酸鉀溶液或溴水。高錳酸鉀溶液的濃度可以是0.002mol/L���,溴水以淡黃色為宜���。若用溴水,通入的時間不宜過長�����,否則因溴易揮發(fā)����,它可被甲烷氣流帶走。溶液也會褪色�。點燃甲烷之前,必須檢查甲烷的純度�����。因為甲烷與空氣混和物中甲烷占5%—15%,或甲烷與氧氣混和物中甲烷占5.4%—59.2%時���,都會發(fā)生爆炸���。欲試驗甲烷與氧氣混和物的爆炸,甲烷與氧氣混和比以1∶2(體積)為最好�����。若為空氣�����,可用1體積甲烷與10體積空氣混和����,但效果不如用氧氣好。
7.氣體的儲存
有些氣體如能儲存?zhèn)溆?��,要比臨時制取來得方便�����,而且易于控制氣流���。
正式生產(chǎn)的儲氣瓶如下圖所示:
它由漏斗Ⅰ、有上口和下口的容器Ⅱ和導氣管Ⅲ所組成����。在收集氣體前要先充滿液體,其操作是:塞住容器的下口��,打開導氣管和漏斗上的活塞�,向漏斗里注入液體(與該氣體不起反應,且該氣體在其中難溶解的液體——通常是水)�����,一直到充滿漏斗的頸部���,使瓶內(nèi)不留有空氣泡��。將氣體充入儲氣瓶的操作是:將儲氣瓶里充滿液體后�����,關閉導氣管和漏斗上的活塞����,把它置于盛有適量液體的水槽中,再拔去容器下口的塞子�。這時容器里的液體受到外部空氣的壓力不會自動向外流出,但可以被氣體排出�����。將欲儲存的氣體用導氣管從容器下部開口導入��,被氣體排出的液體則流入事先準備好的水槽或水盆中���,容器內(nèi)的液面下降到接近容器下部開口的上緣時����,就要停止充氣�。取出導氣管,塞上塞子(必要時再用繩子捆緊)��。欲將氣體從儲氣瓶中導出時��,須向漏斗中加入液體����,打開漏斗和導氣管上的活塞���,氣體即可導出�����。儲氣瓶也有多種自制代用裝置�����。下圖所示的一種是用兩個帶有下口的玻璃瓶裝配成的���,放在上邊的瓶相當于儲氣瓶上的漏斗����,下邊的瓶相當于容器Ⅱ��,從下圖中也很易了解各導管的作用�。

如果沒有帶下口的玻璃瓶,也可用兩只大號的小口瓶(1000ml以上的)如上圖B裝配而成�����。甲瓶的短管上的活塞也可以用安有皮管夾的一段橡皮管連接在短彎管上來代替。儲氣時����,先在甲瓶里盛滿液體,然后把短彎管(或連在短彎管上的橡皮管)跟氣體發(fā)生器的氣體導出管相連接���;使氣體進入甲瓶���,而瓶里的液體通過相連的橡皮管被壓入空瓶乙里。到甲瓶里剩下少量的液體���,只能浸沒長玻璃管的末端時���,儲氣完畢,關閉活塞(或管夾)�����,卸開氣體發(fā)生器的導氣管�����。要用氣體時��,先把儲氣瓶固定在鐵架臺上(或自制的木架上)。使甲瓶在下乙瓶在上����,然后開啟甲瓶上的活塞,乙瓶里的液體就因虹吸作用而流入甲瓶�����,把甲瓶所儲的氣體排出來���。只要使活塞啟開或關閉,就可使氣體放出或停止��。此外����,利用球膽,塑料充氣枕芯�����、游泳圈�����、鐵筒(或大的竹筒)等都可制成簡易儲氣裝置。下圖裝置就是用鐵筒做成的���。儲氣前�,將螺旋夾打開�,使浮筒全部沒入液體中,排盡筒中空氣����。灌氣時,把氣體發(fā)生器的排氣導管與浮筒上的導管連接起來���,氣體就進入浮筒��,并使之浮起��,根據(jù)浮起的高度���,判斷儲氣量的多少,若要停止儲氣�����,就將螺旋夾夾緊���。用氣時����,打開螺旋夾,調(diào)整浮筒上的重物���,結合調(diào)整螺旋夾���,可以恰當?shù)乜刂茪怏w流量。以滿足實驗需要��。
注意事項
1.此實驗成功與否的關鍵取決于藥品是否無水�����。即使是新購回的無水醋酸鈉�,亦應事先干燥后再使用����。
2.堿石灰是苛性鈉和生石灰的混合物(1∶1)。市售堿石灰中加有粉紅色指示劑��,使用前應先烘炒至白色后再用���。該實驗中的CaO并不參與反應��,它的作用是除去苛性鈉中的水分�����、減少苛性鈉與玻璃的作用���,防止試管炸裂��,同時也使反應混合物疏松���,便于甲烷氣體的逸出。
3.該實驗所需的氯氣常溫下可用KMnO4和鹽酸(8mol·L-1)制取�,收集氯氣用排飽和食鹽水法來進行。
實驗十三物質(zhì)的制備與合成研究——氨的合成
實驗目的
1. 初步掌握演示“合成氨”實驗的成敗關健和操作技能����;
2. 探討、研究提高該實驗成功率和演示效果的具體方法���。
實驗原理
實驗用品
鐵架臺(附鐵夾)��,Y形試管��,附導管橡皮塞��,反應管��,直角導管�,橡皮管,燒杯��,酒精燈�����,錐形瓶�,研缽,鑷子�,角匙。
鋅粒����,亞硝酸鈉����,飽和氯化銨,1:4稀硫酸����,石棉(或玻璃絲)�����,還原鐵粉���,酚酞。
實驗步驟
1���、在Y形試管的一邊加入固體亞硝酸鈉��,再加入氯化銨飽和溶液��,另一邊加入鋅粒和稀硫酸(兩邊固體試劑各約一角匙,液體試劑各約3~5ml)��。取一團石棉或玻璃纖維置于研缽中����,石棉上加約半角匙還原鐵粉���,拌勻��。將附有催化劑的石棉放入反應管中���。按下圖所示裝配好實驗裝置�。
2����、在盛有亞硝酸鈉和飽和氯化銨溶液的一邊加熱,到氮氣產(chǎn)生較快時(切忌制氮反應過于激烈)�����。把酒精燈移到催化劑下面加熱��。這時即能產(chǎn)生少量氨���,約3分鐘后����,即能使錐形瓶內(nèi)的酚酞試液變紅���。
討論總結
1、本實驗反應開始后��,為什么要較長時間才能使酚酞變紅。
2����、本實驗中有多個反應,裝置和操作也較復雜,你認為會導至實驗失敗的主要因素有哪些。
3���、你認為本實驗能否作一些改進,使實驗時間及效果更理想一些�。
4��、寫出本實驗的講稿(教案)����,作試講。
實驗十四物質(zhì)的性質(zhì)與反應研究——木炭還原氧化銅
實驗目的
1���、熟練掌握木炭還原氧化銅實驗操作技術����,做到演示時能規(guī)范操作�;
2、尋找并初步掌握木炭還原氧化銅實驗的最佳反應條件以及實驗獲得成功的關鍵��。
實驗用品
試管��、鐵架臺、鐵夾���、附導管的橡皮塞��、藥匙���、研缽、托盤天平���、秤量紙�����、煤氣燈����、酒精噴燈����、酒精燈、蒸發(fā)皿��、玻棒�����、火柴�、炭粉、氧化銅粉��、澄清石灰水�����。
實驗步驟
1���、如下所示連接裝置�,檢查氣密性�����。
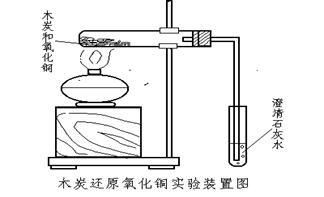
2����、將木炭粉和黑色氧化銅粉分別烘干,按一定質(zhì)量比放入研缽中研磨混勻�����。把混合物放入試管底部,將導管伸入裝有澄清石灰水的小試管中�����。(操作前要制定計劃�,定計劃前可參閱下文或其他資料)
3、選一種燈具對試管加熱���。
4���、觀察到實驗成功后停止加熱,冷卻試管至室溫���,把試管中產(chǎn)物倒在一張紙上���。
5、對上述各步的實驗現(xiàn)象��、效果進行分析�����、解釋��。
討論總結
1、炭和氧化銅充分反應其理論上的質(zhì)量比為1:13.3�����,但實際進行反應時�����,試管里的氧氣要消耗一些炭��,且反應中還會產(chǎn)生一氧化碳�,故炭的用量就會偏高�。有人曾提出以1:1、1:5����、1:7、1:10等的質(zhì)量比來做實驗���,當然比例太大或太小�����,效果都會受到影響�����。要現(xiàn)象明顯��,反應速度快����,這就要通過自己動手摸索,否則�,既浪費試劑藥品,又得不到理想的結果�����,有時甚至還會使實驗失敗���。為此��,研究者應自已制定出具體的操作和測試的方案�����、計劃�����,做幾次(或多次)平行對比實驗�,找到本實驗反應的最佳質(zhì)量比。
2��、在木炭還原氧化銅實驗中��,反應物實際的最佳質(zhì)量比值要受到諸多因素的影響�����,例如反應試管的大小��、火焰的溫度����、反應物顆粒的大小及混合的程度�、反應物堆積的形態(tài)、反應物的含水量等等�。所以說,影響本實驗最終結果的因素不僅僅是反應物的質(zhì)量比��。在影響本實驗結果的眾多因素中��,不少專家認為反應物的質(zhì)量比、反應物研和的程度���、反應物的干燥程度及加熱燈焰的溫度等是較為主要的幾項因素����。為此�,試驗者可以先選擇1~2項因素作試驗對比分析。試驗方案請自行設計并定出操作步驟�、計劃等,然后才進行操作�、試驗、比較����,最后對該實驗成功的關鍵提出自己的觀點。
3�、寫出該實驗的演示講稿,并根據(jù)實驗內(nèi)容講解碳的一個重要性質(zhì)——作為還原劑與某些氧化物發(fā)生反應�。
4、根據(jù)本實驗原理����,試講述工業(yè)上鐵、鋅等金屬的冶煉方法��。
實驗十五化學反應條件實驗研究——氨催化氧化制硝酸
實驗目的
1、熟練掌握演示“氨催化氧化制硝酸”實驗的操作技能�����。
2�、了解該實驗不同的幾套裝置,提高對實驗裝置的選擇���、評估及改進等能力��。
3�����、提高實驗研究的初步能力。
實驗用品
錐形瓶�、園底燒瓶、雙孔附導管橡皮塞二個���、氣唧�、反應管�、燒杯、玻璃纖維���、重鉻酸銨���、氨水���、石蕊試液。
實驗原理
氨的催化氧化制硝酸反應是一個很復雜的反應過程��。研究表明�,根據(jù)不同的反應條件可以生成不同的氧化產(chǎn)物,這可由下面幾個反應式給于說明:
4NH3+5O2→4NO+6H2O
4NH3+4O2→2N2O+6H2O
4NH3+3O2→2N2+6H2O
上述幾個反應都是不可逆反應�����,所以實際上不可能用改變反應平衡的方法����,使氨的氧化反應只生成NO,而只能選擇相適宜的反應條件��,改變可能發(fā)生的各反應的速度�,即提高主反應的速度,使其他副反應受到抑制��。事實證明����,選用選擇性強的催化劑是唯一能相對阻止其他副反應發(fā)生的切實可行的辦法����。所以催化劑的選擇是本實驗成功的關鍵之一�。眾所周知,鉑是本實驗最佳的催化劑�����,在本實驗中其催化氨氧化的速度比常用的非鉑催化劑的速度要大100倍左右�。但由于鉑的價格昂貴,所以在中學常選用三氧化二鉻����、氧化鈷、銅等為本實驗的催化劑����。
三氧化二鉻是最常用的催化劑���,簡易的制取方法是取1~2克重鉻酸銨放在新的石棉網(wǎng)上�����,用煤氣燈加熱使之分解��。分解時桔紅色的重鉻酸銨變?yōu)榫G色的三氧化二鉻��,體積也膨脹多倍�����。其反應式為:

上述反應有水生成�����,所以分解反應結束后���,還應繼續(xù)加熱片刻��,使三氧化二鉻充分干燥��,以提高其催化的活性�����。三氧化二鉻可不用載體直接作催化劑����,也可將它研成粉狀與石棉相混,使之載于石棉上用于催化�����。另外還可將磚瓦砸成赤豆粒大小的碎塊��,浸入飽和的重鉻酸銨溶液中���,數(shù)小時后進行干燥����、灼燒至重鉻酸銨分解再用于催化�。
氧化鈷也是本實驗的較好催化劑之一,它可以不用載體直接用作催化劑�,也可制成氧化鈷石棉用于催化。其方法是將硝酸鈷加熱至分解�,把得到的黑色氧化鈷粉末與約10倍質(zhì)量的石棉充分攪拌混勻即可。也可將石棉浸泡在硝酸鈷溶液中�����,然后取出烘干��、灼燒獲得��。另外���,還可把紅磚瓦砸成赤豆粒大小�����,干燥后浸入硝酸鈷飽和溶液中�,一至二天后一起倒入蒸發(fā)皿中加熱蒸發(fā)����、灼燒(在通風櫥中進行),使硝酸鈷完全分解成黑色的氧化鈷(Co2O3)�����。這樣制得的催化劑���,使用較長時間后仍可保持較高的活性����。
氧化鐵對本實驗也有一定的催化作用��,被不少中學教師采用���。一般是制成活性氧化鐵石棉用于催化反應���。制取方法是:在氫氧化銨溶液中注入少量氯化鐵即有氫氧化鐵沉淀生成����,將其過濾����、水洗后與石棉相混合,再加熱灼燒使之分解即可�����。如將堿式碳酸銅加熱分解成活性氧化銅用作催化劑�,效果比氧化鐵好。
另外�����,還可選用銅絲���、銅網(wǎng)�、細銅絲團等金屬銅及五氧化二釩、二氧化錳等金屬氧化物作為本實驗的催化劑��。
除了催化劑���,本實驗成功的關鍵還包括鼓入混合氣體中氨的濃度和反應溫度的控制。另外�,實驗裝置的選擇也會影響本實驗的演示效果。
氨的催化氧化反應為強放熱反應����,但溫度過低,反應速度則太慢�����。所以本實驗還是要在反應前對催化劑作預先加熱處理����。另外,不同的溫度對NO的產(chǎn)率也有影響�,例如用鉑、銠催化劑時����,最佳的反應溫度為700~800℃。
從化學反應式可知每一摩爾的氨需要氧氣1.25摩爾。但采用這一理論上的比例會使NO的產(chǎn)率很低��,經(jīng)研究證明���,氧氣與氨的比值達到1.8:1左右�,其NO的產(chǎn)率可達到最高點���,該比值相當于在氨和空氣的混合氣體中氨的含量為10%左右��。采用純氧當然有利于NO的生成����,但純氧和氨混合后極易爆炸��,而且選用氧氣后會導致裝置及操作的復雜化���。所以本實驗一般都選用空氣和氨相混合進行反應�,氨在混合氣體中的濃度�����,往往由室溫�、氨水的濃度及用量等有關因素決定����。
該實驗的不少設計使用了干燥劑和除氨劑��,用來吸除水氣和反應后多余的氨�����。然而這些并非是實驗成����、敗的關鍵��,有些裝置不用干燥劑���、除氨劑等��,實驗仍可確保成功����。而氨水的濃度�����、反應溫度、鼓入反應氣體的速度是至關緊要的��。如氨的濃度控制不好��,有時只有白煙產(chǎn)生���,有時只能觀察到冷凝后形成的水珠�,燒杯中的石蕊試液也不變紅�����。有時實驗時間拖得很長也只能產(chǎn)生淡淡的黃色��。由此可見本實驗中氨在混合氣體中的濃度等因素是不能忽略的重要關鍵之一����。
實驗裝置

氨的催化氧化制硝酸的實驗設計裝置有不少。用辯證的觀點看����,一個裝置在具備種種優(yōu)點、長處的同時����,難免會產(chǎn)生另一些負面的影響���。例如對某個實驗的各個環(huán)節(jié)、各種現(xiàn)象都考慮得十分周到���,使實驗每個細小的步驟�����、變化�、現(xiàn)象都能清晰�、精確地展示在學生面前��,那么該實驗的裝置或操作等往往就比較繁瑣復雜���,可能會使一些教師不愿或不能采用���,反之也一樣。氨的催化氧化制硝酸的實驗設計裝置有很多��,在有關書和期刊上發(fā)表過的�����,少說也有十多個。下面僅選出五種供參考��、討論:
圖1���,是采用內(nèi)熱式的加熱裝置��,其特點是加熱速度快�、方便(不用點酒精燈)��、裝置及操作較簡單��。但要有電源��,且要注意用電的安全��。圖2��,也是一種較筒易的裝置����,其特點是氨水耗用量少,操作步驟筒易�����。但實驗成功率會產(chǎn)生一些問題,這就需要演示者化較多時間和精力在課前作充分的準備����。
上述兩實驗裝置的尾氣沒安排處理,使NO2變?yōu)橄跛徇€要再加入
水和指示劑���。
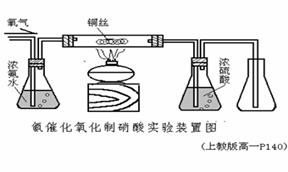 圖3���、圖4為現(xiàn)行上海市兩套中學化學教材中的該實驗演示裝置。
圖3���、圖4為現(xiàn)行上海市兩套中學化學教材中的該實驗演示裝置。
圖3
圖4
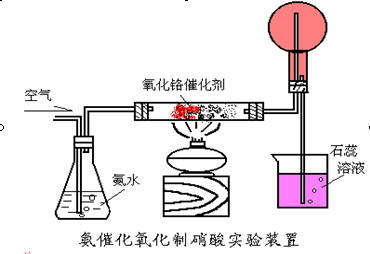
圖5
圖5為本次實驗操作練習和試講演示的選用裝置���。
實驗步驟
1�����、用重鉻酸銨自制三氧化二鉻催化劑。(重鉻酸銨取蠶豆般大小即可�,太多造成浪費、噴料)
2�����、按圖5所示裝配好實驗裝置�����,并檢查氣密性。
3��、裝入玻璃棉��、催化劑��,注入100ml約2:1的氨水(氨水濃度視室溫可作適當變化)�,小燒杯中注入半杯水并滴加1~2ml石蕊試液。
4�、點燃酒精燈(或煤氣燈),加熱催化劑��。
5��、催化劑受熱由草綠色變?yōu)榛液谏?����,慢慢鼓入空氣�����,注意觀察催化劑是否有發(fā)紅(放熱)現(xiàn)象。
6��、催化劑的現(xiàn)象如正常����,可加快鼓氣速度,注意觀察圓底燒瓶中氣體的顏色變化及小燒杯中石蕊試液的顏色變化�����。
7�����、記錄實驗各步有關條件和相關現(xiàn)象�����、數(shù)據(jù)�。
實驗說明
如果需要對各種催化劑的催化效果進行研究、比較���,則可在選擇好各種催化劑后再選擇并固定一種實驗裝置,進行多次平行實驗并記錄各種催化劑所產(chǎn)生的實驗效果�,如產(chǎn)生NO2的量(通過顏色的比較)、催化劑的狀態(tài)(是否發(fā)紅等)����、完成反應的時間等等�����。最后將各個實驗的有關結果通過列表一一表述清楚���,以便于通過分析給出科學的判斷。
如果想探索氨水濃度對本實驗的影響���,則可選擇一種裝置����,并固定溫度和其他反應條件���,選擇4~6種不同濃度的氨水進行對照試驗�,并把各種試驗結果整理成表�,便于最后分析。下面的表格可供同學參考�����、選用。
不同濃度氨水進行氨氧化實驗的現(xiàn)象
氨水濃度
濃氨水:水
| 催化劑現(xiàn)象
| 氧化瓶中的現(xiàn)象
| 實驗所用時間
|
1 : 0
|
|
|
|
2 : 1
|
|
|
|
1.5 : 1
|
|
|
|
1 : 1
|
|
|
|
0.5 : 1
|
|
|
|
如果要對各實驗裝置進行比較�����、研究���,則可相對固定其他各反應條件����,選用不同的儀器���、裝置進行對比實驗��,同樣作觀察和記錄�,并可把各項記錄整理成表�����,最后經(jīng)分析給出結論�����。
實驗分析和討論
1���、你認為影響本實驗成功率的關鍵因素有哪些?如何解決���。
2、上述圖1~5五個實驗裝置中����,你認為選擇哪一個更好一些?為什么?
3、圖3��、4�、5三個實驗裝置比較相似,試分別進行評估分析(指出各自的優(yōu)缺點)�����。
4����、查閱有關資料后,結合自已的認識�,設計一個與上述不同的氨的催化氧化實驗裝置,畫出裝置圖�����,簡要闡述設計思路。
5���、寫出該實驗演示講稿(實驗教案)���,準備演示、試講��。
實驗十六 趣味性化學實驗的研究-金屬鏡
實驗目的
1���、探索生成光亮銀(銅)鏡的實驗條件��,掌握相關的實驗操作���。
2、探討銀(銅)鏡反應化學原理的教學方法���。
3�、實驗用品
試管�、試管夾、酒精燈���、培養(yǎng)皿���、臺秤����、角匙���、石棉網(wǎng)、10%氫氧化鈉溶液����、5%硝酸銀溶液、0.5M氨水�����、6M氨水�、固體硝酸銀(cp)、7%硫酸銅溶液�����、6M鹽酸�、3%葡萄糖溶液、37%甲醛溶液���、*甲酸鈉溶液��、**酒石酸鉀鈉溶液����、***銀氨溶液、****10%氯化亞錫溶液��。
*甲酸鈉溶液:10g氫氧化鈉置于燒杯中�����,慢慢滴定4.5ml甲酸鈉溶液(邊滴邊攪拌)�,加100ml蒸餾水即成。
**酒石酸鉀鈉溶液:四水酒石酸鉀鈉8g和氫氧化鈉2.6g加到20ml蒸餾水中�����。
***銀氨溶液:試管中加1 ml 5%硝酸銀溶液��,加1滴5%氫氧化鈉溶液�����,在不斷振蕩下滴加稀氨水至沉淀剛好溶解為止����。
****10%氯化亞錫溶液:秤取2克氯化亞錫��,先溶于少量6M鹽酸中�,再稀釋至20m��。
實驗步驟
(一)�����、銀鏡反應
1����、取一支試管����,加4~6滴酒石酸鉀鈉溶液和1ml蒸餾水,再加10滴甲酸鈉溶液����,振蕩后加8~10滴銀氨溶液,溶液呈淡棕色��,再滴入1~2滴濃氨水��,振蕩后溶液變成無色。在50~700C水浴中加熱約30~40秒即有銀鏡生成�����。
2����、在試管中加入3~4滴甲酸鈉溶液和2ml蒸餾水,充分振蕩�,邊滴加銀氨溶液邊振蕩至沉淀剛好溶解(約12滴)。將試管置于700C水中加熱至近沸點即有銀鏡生成(約8分鐘)����。
(二)、銅鏡反應
1���、用肥皂洗凈手���,用去污粉將培養(yǎng)皿擦洗干凈,再把洗滌劑放在小燒杯中加水溶解���,加熱至800C���,將它倒入培養(yǎng)皿中��,靜置冷至室溫���,傾去后分別用水和蒸餾水全面淋洗,備用�����。
2��、將20ml氯化亞錫溶液倒入培養(yǎng)皿中��,靜止5分鐘后傾去�����,用蒸餾水小心淋洗����,待干����。
3、在50ml燒杯中加入2滴5%硝酸銀和1滴氫氧化鈉溶液,逐滴加入0.5M氨水至沉淀剛好溶解��,加入15 ml蒸餾水���,攪拌后再加入3ml 3%葡萄糖溶液�����,混合后立即倒入培養(yǎng)皿中�����,靜置5分鐘����,當溶液呈棕色后傾去�����,用蒸餾水小心淋洗���,再用烘箱烘干或晾干��。
4���、50ml燒杯中充分混合等體積(約各7ml )7%的硫酸銅溶液��、酒石酸鉀鈉溶液和37%甲醛溶液�。立即倒入培養(yǎng)皿中����,靜置5分鐘即可形成銅鏡。
作業(yè)
1����、說明銀、銅鏡形成的條件和反應機理��。
2��、把銀鏡反應作為演示實驗��、銅鏡制作作為活動課實驗�,選擇其中一個寫好講稿�,并作試講。
實驗十七 水中溶解氧的測定(碘量法)
實驗目的和要求
1.掌握碘量法測定溶解氧的原理和方法�����。
實驗原理
水樣中加入硫酸錳和堿性碘化鉀,水中溶解氧將低價錳氧化成高價錳���,生成四價錳的氫氧化物棕色沉淀�。加酸后����,氫氧化物沉淀溶解形成可溶性四價錳 ,
, 與碘離子反應釋出與溶解氧量相當?shù)挠坞x碘�,以淀粉作指示劑,用硫代硫酸鈉滴定釋出碘���,可計算溶解氧的含量�����。
與碘離子反應釋出與溶解氧量相當?shù)挠坞x碘�,以淀粉作指示劑,用硫代硫酸鈉滴定釋出碘���,可計算溶解氧的含量�����。
儀器
溶解氧瓶250—300mL��,滴定管25mL����,錐形瓶250mL�����。
試劑
1.濃硫酸 (
( )。
)。
2.硫酸錳溶液:稱取480g硫酸錳( 或364g
或364g )溶于水中����,稀釋至1000mL。此溶液加至酸化過的碘化鉀溶液中�,遇淀粉不得產(chǎn)生藍色。
)溶于水中����,稀釋至1000mL。此溶液加至酸化過的碘化鉀溶液中�,遇淀粉不得產(chǎn)生藍色。
3.堿性碘化鉀溶液:稱取500gNaOH溶于300—400mL去離子水中���,另稱取150gKI(或135gNaI)溶于200mL中�,待NaOH溶液冷卻后��,將兩溶液合并混勻���,用水稀釋至1000mL��。如有沉淀�����,靜置24h�����,倒出上層澄清液�����,貯于棕色瓶中�。用橡皮塞塞緊�����,避光保存����。此溶液酸化后,遇淀粉不得產(chǎn)生藍色�����。
4.1%淀粉溶液:稱取1g可溶性淀粉���,用少量水調(diào)成糊狀�,用剛煮沸的水沖稀至100mL���。冷卻后��,加入0.1g水楊酸或0.4gZnC12防腐���。
5.重鉻酸鉀標準溶液( ):稱取于105一110℃烘干2h并冷卻的
):稱取于105一110℃烘干2h并冷卻的 1.2258g��,溶于水中�,轉移至1000mL容量瓶中�,用水稀釋至刻線,搖勻�。
1.2258g��,溶于水中�,轉移至1000mL容量瓶中�,用水稀釋至刻線,搖勻�。
6.硫代硫酸鈉溶液:稱取6.2g硫代硫酸鈉( ),溶于1000mL煮沸放涼的水中����,加入0.2g碳酸鈉。貯于棕色瓶中�。在暗處放置7-14天后標定。
),溶于1000mL煮沸放涼的水中����,加入0.2g碳酸鈉。貯于棕色瓶中�。在暗處放置7-14天后標定。
標定:于250mL碘量瓶中�����,加入100mL水和1gKI�����,用移液管吸取10.00mL0.025mol/L 標準溶液�、5mL(l+5)
標準溶液�、5mL(l+5) 溶液密塞,搖勻��。置于暗處5min���,取出后用待標定的硫代硫酸鈉溶液滴定至由棕色變?yōu)榈S色時���,加入1mL淀粉溶液,繼續(xù)滴定至藍色剛好退去為止����,記錄用量。計算硫代硫酸鈉的濃度:
溶液密塞,搖勻��。置于暗處5min���,取出后用待標定的硫代硫酸鈉溶液滴定至由棕色變?yōu)榈S色時���,加入1mL淀粉溶液,繼續(xù)滴定至藍色剛好退去為止����,記錄用量。計算硫代硫酸鈉的濃度:

式中�����, C—硫代硫酸鈉的濃度��,mol/L:
V一滴定時消耗硫代硫酸鈉的體積�����,mL����。
實驗步驟
1.采集水樣時,先用水樣沖洗溶解氧瓶后���,沿瓶壁直接注入水樣或用虹吸法將細管插入溶解氧瓶底部���,注入水樣至溢流出瓶容積的1/3一1/2左右��。要注意不使水樣曝氣或有氣泡殘存在溶解氧瓶中��。
2.溶解氧的固定:用刻度吸管吸取1mL 溶液��,加入裝有水樣的溶解氧瓶中����,加注時����,應將吸管插入液面下。按上法����,加入2mL堿性KI溶液。蓋緊瓶塞�����,將樣瓶顛倒混合數(shù)次,靜置����。待沉淀降至瓶內(nèi)一半時,再顛倒混合一次����,待沉淀物下降至瓶底�����。一般在取樣現(xiàn)場固定��。
溶液��,加入裝有水樣的溶解氧瓶中����,加注時����,應將吸管插入液面下。按上法����,加入2mL堿性KI溶液。蓋緊瓶塞�����,將樣瓶顛倒混合數(shù)次,靜置����。待沉淀降至瓶內(nèi)一半時,再顛倒混合一次����,待沉淀物下降至瓶底�����。一般在取樣現(xiàn)場固定��。
3.析出碘:輕輕打開瓶塞���,立即用吸管插入液面下加入2.0ml濃硫酸����,小心蓋緊瓶塞�����。顛倒混合��,直至沉淀物全部溶解為止。放置暗處5min��。
4.樣品的測定:用移液管吸取100.0mL上述溶液于250mL錐形瓶中�����,用 標準溶液滴定至溶液呈淡黃色�,加入1mL淀粉溶液。繼續(xù)滴定至藍色剛剛退去�,記錄硫代硫酸鈉溶液用量。
標準溶液滴定至溶液呈淡黃色�,加入1mL淀粉溶液。繼續(xù)滴定至藍色剛剛退去�,記錄硫代硫酸鈉溶液用量。
計算

式中:  —水中溶解氧的濃度��,mg/L���;
—水中溶解氧的濃度��,mg/L���;
C—硫代硫酸鈉標準溶液濃度���,mol/L;
V—硫代硫酸鈉標準溶液用量,ml��。
實驗十八 “氯氣與氫氣的光化反應”LE演示實驗的研究
實驗目的
1.掌握氯氣與氫氣的混和氣體見光爆炸實驗的成功關鍵及演示技能����;
2.探索氯氣與氫氣的混和比、空氣的混入量��、光源及光強度、氣體的混和方式等條件對實驗效果的影響��??偨Y本實驗的成功經(jīng)驗。
實驗原理及要求
氯氣與氫氣在暗處混和是安全的�����。但將混和物曝光����,則迅速化合而爆炸�����。
這是一個光化學反應�����,其原理如下:
Cl2+hv→2Cl2
Cl2+H2→HCl+H2
H2+Cl→HCl+Cl2
反應循環(huán)往復��,繼續(xù)進行�,使整個反應瞬息完成。反應放出的熱使生成的氯化氫氣體的體積驟然膨脹而爆炸:
H2(g)+Cl2(g)=2HCl(g)+184.7kJ
本實驗的基本要求是:
1.氯氣與氫氣的混和氣體在強光照射下發(fā)出強烈的爆炸聲����,并把瓶口的覆蓋物沖開�����;
2.反應后瓶口上方可見白霧生成(鹽酸酸霧)����;
3.立即向反應后的容器中注入適量的水��,用毛玻璃片蓋住瓶口�����。震蕩����,再用酸堿指示劑證明有鹽酸生成。
實驗步驟
1.準備
在正式進行研究實驗之前�,要求做好以下準備:
(1)鉆研中學化學課本中本實驗的內(nèi)容及相應的課文,查閱本實驗的有關資料����。明確本實驗在中學化學教學中的目的和要求,了解已有的經(jīng)驗及尚存的問題�。
(2)制訂研究計劃�����。
在分析和鉆研本實驗在中學化學教學中的地位和作用以及本實驗的內(nèi)容和要求的基礎上�����,借鑒別人已有的經(jīng)驗���,寫出進行和研究這個實驗的計劃。
內(nèi)容包括:研究課題�、研究步驟、操作要點�、注意事項、所用儀器���、藥品和材料的名稱、規(guī)格及用量等項���,交實驗指導教師征求意見���,確定研究方案。
(3)向儀器藥品供應室填報并領取所需的儀器����、藥品和材料���,做好清洗裝配等準備工作。
2.進行研究實驗
在排定的時間內(nèi)��,按照已確定的研究計劃進行實驗和研究��。
3.討論總結����,寫出書面總結報告
報告的內(nèi)容可重點總結本實驗成功的關鍵、光源及氯氣與氫氣的混和比對實驗效果的影響�����。